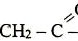pembahasan selanjutnya adalah
- senyawa karbon,
- energi ikatan (termokimia),
- laju reaksi,
- persamaan laju reaksi, dan
- pergeseran kesetimbangan kimia.
Soal No. 21 tentang Senyawa Karbon

Nama senyawa yang merupakan isomer fungsi dari senyawa tersebut adalah ….
A. etil etanoat
B. etoksi propana
C. asam butanoat
D. asam metil butanoat
E. metil propanoat
Pembahasan
Beberapa isomer fungsi yang perlu Anda hafal.
| Senyawa | Isomer Fungsi |
| alkena | isoalkana |
| alkanol (alkohol) | alkoksi alkana (eter) |
| alkanal (aldehid) | alkanon (keton) |
| asam alkanoat (asam karboksilat) | alkil alkanoat (ester) |
Nama senyawa pada soal di atas adalah metil propanoat dari golongan alkil alkanoat. Golongan alkil alkanoat berisomer fungsi dengan golongan asam alkanoat. Di antara opsi jawaban, yang merupakan golongan asam alkanoat adalah asam butanoat dan asam metil butanoat.
Sementara itu, senyawa dan isomernya selalu mempunyai jumlah atom C yang sama. Senyawa di atas mempunyai jumlah atom C sebanyak 4. Mari kita periksa, opsi mana yang paling tepat.
- asam butanoat (jumlah atom C = 4)
- asam metil butanoat (metil = 1, butanoat = 4, total atom C = 5)
Jadi, nama senyawa yang merupakan isomer fungsi dari senyawa tersebut adalah asam butanoat (C).
Perdalam materi ini Pembahasan Kimia UN: Senyawa Karbon.
Soal No. 22 tentang Energi Ikatan (Termokimia)
HBr(g) → ½H2(g) + ½Br2(g) ∆H = +36 kJ/mol
H2(g) → 2H(g) ∆H = +434 kJ/mol
Br2(g) → 2Br(g) ∆H = +158 kJ/mol
Energi ikatan H−Br dalam molekul HBr adalah ….
A. −332 kJ/mol
B. −166 kJ/mol
C. +166 kJ/mol
D. +260 kJ/mol
E. +332 kJ/mol

Pembahasan
Energi ikatan H−Br dapat ditentukan dari reaksi
HBr(g) → ½H2(g) + ½Br2(g), ∆H = +36 kJ/mol
Perumusan ∆H untuk energi ikatan adalah
∆H = energi ruas kiri − energi ruas kanan
+36 = H−Br − (½ × 434
+36 = H−Br − 296
H−Br = +36 + 296
= +332
Jadi, energi ikatan H−Br dalam molekul HBr adalah +332 kJ/mol (E).
Perdalam materi ini di Pembahasan Kimia UN: Termokimia.
Soal No. 23 tentang Laju Reaksi
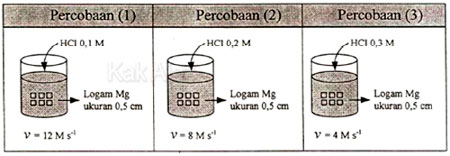
Berdasarkan data percobaan tersebut, yang merupakan variabel bebas, variabel terkontrol, dan variabel terikat adalah ….
A. konsentrasi HCl, luas permukaan logam Mg, laju reaksi
B. konsentrasi HCl, laju reaksi, luas permukaan logam Mg
C. luas permukaan logam Mg, konsentrasi HCl, laju reaksi
D. laju reaksi, konsentrasi HCl, luas permukaan logam Mg
E. laju reaksi, luas permukaan logam Mg, konsentrasi HCl
Pembahasan
Pengertian ketiga variabel di atas adalah sebagai berikut:
- Variabel bebas adalah variabel yang sengaja diubah-ubah untuk mendapatkan hubungan antara besaran yang satu dengan yang lain. Pada tabel di atas, konsentrasi HCl sengaja diubah-ubah pada setiap percobaan dari 0,1 M, 0,2 M, dan 0,3 M.
- Variabel terkontrol adalah variabel yang sengaja dipertahankan tetap. Pada tabel di atas, logam Mg ukurannya dipertahankan tetap 0,5 cm.
- Variabel terikat adalah variabel hasil, nilainya berubah karena perubahan variabel bebas. Pada tabel di atas, laju reaksi (v) nilai berubah pada setiap percobaan dari 12 M/s, 8 M/s, dan 4 M/s.
Jadi, yang merupakan variabel bebas adalah konsentrasi HCl, variabel terkontrol adalah luas permukaan logam Mg, dan variabel terikat adalah laju reaksi (A).
Perdalam materi ini di Pengertian Variabel Bebas, Tetap, dan Terikat.
Soal No. 24 tentang Persamaan Laju Reaksi
NO(g) + Cl2(g) → NOCl2(g)
disajikan dalam tabel berikut:
| Percobaan | [NO] (M) | [Cl2] (M) | Laju Reaksi (M/s) |
| 1 | 0,2 | 0,1 | 0,24 |
| 2 | 0,2 | 0,2 | 0,48 |
| 3 | 0,4 | 0,2 | 1,92 |
Rumus persamaan laju reaksi yang benar adalah ….
A. v = k[NO]2[Cl2]
B. v = k[NO][Cl2]
C. v = k[NO][Cl2]2
D. v = k[NO]2[Cl2]2
E. v = k[Cl2]
Pembahasan
Rumus baku persamaan laju reaksi tersebut adalah
v = k[NO]m[Cl2]n
dengan m dan n adalah orde reaksi.
Mari kita tentukan masing-masing orde reaksinya.
Orde reaksi [NO] dapat ditentukan saat [Cl2] tetap, yaitu percobaan 2 dan 3.
![Penentuan orde reaksi [NO] Penentuan orde reaksi [NO]](https://1.bp.blogspot.com/-a_pW97IkKS0/WFaOQ3uljOI/AAAAAAAAGlg/XW02fFBAWvA85LaqLIq1j7RWiNuVOVLsgCLcB/s1600/orde-NO.jpg)
Orde reaksi [Cl2] dapat ditentukan saat [NO] tetap, yaitu percobaan 1 dan 2.
![Penentuan orde reaksi [Cl2] Penentuan orde reaksi [Cl2]](https://2.bp.blogspot.com/-n6ENo-tBbYk/WFaPeKtdsgI/AAAAAAAAGls/CFnLHw_hEggZoC4uSemdHnMc7fr5EnVyACLcB/s1600/orde-Cl2.jpg)
Dengan demikian, rumus persamaan laju reaksi tersebut adalah
v = k[NO]2[Cl2]
Jadi, persamaan laju reaksi yang benar adalah opsi (A).
Perdalam soal no. 23 dan 24 di Pembahasan Kimia UN: Laju Reaksi.
Soal No. 25 tentang Pergeseran Kesetimbangan Kimia
2NO2(g) ⇄ N2O4(g) ∆H = −59,22 kJ
Pernyataan berikut yang benar untuk perubahan warna gas adalah ….
A. bertambah coklat jika suhu dinaikkan
B. memudar menjadi tak berwarna jika konsentrasi gas NO2 diperkecil
C. bertambah coklat jika konsentrasi N2O4 diperkecil
D. memudar menjadi tak berwarna jika tekanan diperkecil
E. bertambah coklat jika volume diperkecil
Pembahasan
Gas NO2 berwarna coklat dan terletak di ruas kiri sedangkan gas N2O4 tak berwarna dan terletak di ruas kanan. Artinya, jika warna semakin coklat maka reaksi bergeser ke kiri sedangkan jika warna memudar maka reaksi bergeser ke kanan.
Mari kita cermati setiap opsi jawaban di atas!
- Reaksi di atas adalah reaksi eksoterm (∆H bernilai negatif). Jika suhu dinaikkan maka reaksi akan bergeser ke arah endoterm (ke kiri) sehingga warna semakin coklat. [opsi A benar]
- Jika konsentrasi NO2 diperkecil maka reaksi akan bergeser ke kiri sehingga warna semakin coklat. [opsi B salah]
- Tidak mungkin memperkecil konsentrasi N2O4 karena gas tersebut adalah hasil reaksi. [opsi C salah]
- Jika tekanan diperkecil maka reaksi akan bergeser ke koefisien besar (ke kiri) sehingga warna semakin coklat. [opsi D salah]
- Jika volume diperkecil maka reaksi akan bergeser ke koefisien kecil (ke kanan) sehingga warna memudar. [opsi E salah]
Jadi, pernyataan yang benar untuk perubahan warna gas adalah opsi (A).
Perdalam materi ini di Pembahasan Kimia UN: Kesetimbangan Kimia.
Simak Pembahasan Soal Kimia UN 2016 selengkapnya.
Dapatkan pembahasan soal dalam file pdf di sini.
Terimakasih
Semoga Bermanfaat