pembahasan selanjutnya adalah
- kelarutan dan hasil kali kelarutan,
- bilangan oksidasi,
- gaya antarmolekul,
- sel elektrolisis dan hukum faraday, serta
- termokimia.
Soal No. 16 tentang Kelarutan dan Hasil Kali Kelarutan
A. 0,25 gram
B. 0,50 gram
C. 0,75 gram
D. 1,00 gram
E. 1,50 gram
Pembahasan
Reaksi yang terjadi adalah
CaCl2 + Na2CO3 → CaCO3 + 2NaCl
Karena koefisien CaCO3 sama dengan koefisien CaCl2 maka nilai mol keduanya juga sama.
mol CaCO3 = mol CaCl2
= 0,1 M × 50 mL
= 5 mmol
Massa CaCO3 yang mengendap adalah
massa CaCO3 = mol CaCO3 × Mr CaCO3
= 5 mmol × 100
= 500 mg
= 0,5 gram
Catatan:
Data Ksp yang dicantumkan pada soal sebenarnya untuk menentukan apakah CaCO3 mengendap atau larut. Tetapi karena soal menanyakan endapan CaCO3 maka sudah pasti yang mengendap adalah CaCO3. Sehingga data Ksp tersebut tidak berguna.
Jadi, massa endapan CaCO3 yang terjadi adalah 0,5 gram (B).
Perdalam materi ini di Pembahasan Kimia UN: Kelarutan dan Hasil Kali Kelarutan.
Soal No. 17 tentang Bilangan Oksidasi
A. +1, +2, +3
B. +1, +3, +2
C. +2, +4, +1
D. +2, +3, +1
E. +3, +4, +3

Pembahasan
Aturan penentuan bilangan oksidasi pada senyawa tersebut adalah
- biloks O = −2
- jumlah biloks dalam senyawa = 0
Nah, dengan 2 aturan di atas kita dapat menentukan biloks unsur yang lain sebagai berikut:
N + (−2) = 0
N = +2
C + 2(−2) = 0
C = +4
2Cl + (−2) = 0
2Cl = +2
Cl = +1
Jadi, bilangan oksidasi unsur nitrogen, karbon, dan klorin pada senyawa tersebut adalah +2, +4, dan +1 (C).
Perdalam materi ini di Pembahasan Kimia UN: Reaksi Redoks dan Elektrokimia.
Soal No. 18 tentang Gaya antarmolekul
(1) BeH2
(2) CH4
(3) H2O
(4) HF
(5) H2S
Senyawa yang antarmolekulnya hanya terdapat gaya London adalah ….
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (4)
D. (3) dan (4)
E. (4) dan (5)
Pembahasan
Gaya London adalah gaya tarik-menarik antarmolekul nonpolar. Salah satu ciri molekul nonpolar adalah tidak mempunyai pasangan elektron bebas.
Mari kita periksa senyawa-senyawa di atas satu per satu.
- BeH2: atom Be golongan IIA (mempunyai 2 elektron terluar) mengikat 2 atom H. Berarti semua elektron terluarnya terpakai atau tidak mempunyai pasangan elektron bebas. [nonpolar]
- CH4: atom C golongan IVA (mempunyai 4 elektron terluar) mengikat 4 atom H. [nonpolar]
- H2O: atom O golongan VIA (mempunyai 6 elektron terluar) mengikat 2 atom H. Berarti tersisa 4 elektron atau 2 pasang elektron bebas. [polar]
- HF: atom F golongan VIIA (mempunyai 7 elektron terluar) mengikat 1 atom H sehingga tersisa 6 elektron atau 3 pasang elektron bebas. [polar]
- H2S: atom S golongan VIA (mempunyai 6 elektron terluar) mengikat 2 atom H sehingga tersisa 4 elektron atau 2 pasang elektron bebas. [polar]
Jadi, senyawa yang antarmolekulnya hanya terdapat gaya London adalah nomor 1 dan 2 (A).
Perdalam materi ini di Pembahasan Kimia UN: Jenis Ikatan Kimia
Soal No. 19 tentang Sel Elektrolisis dan Hukum Faraday
A. 200 detik
B. 500 detik
C. 1.000 detik
D. 1.930 detik
E. 9.650 detik
Pembahasan
Nikel (II) sulfat berarti valensi nikel adalah +2 atau n = 2.
Untuk menyelesaikan soal di atas harus menerapkan hukum I Faraday.
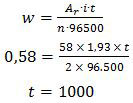
Jadi, waktu yang diperlukan untuk proses tersebut adalah 1000 detik (C).
Perdalam materi ini di Pembahasan Kimia UN: Sel Elektrolisis dan Hukum Faraday.
Soal No. 20 tentang Termokimia
A. HCl(aq) + KOH(aq) → KCl(aq) + H2O(l), ∆H = −50,4 kJ.mol−1
B. HCl(aq) + KOH(aq) → KCl(aq) + H2O(l), ∆H = −25,2 kJ.mol−1
C. HCl(aq) + KOH(aq) → KCl(aq) + H2O(l), ∆H = +25,2 kJ.mol−1
D. HCl(aq) + KOH(aq) → KCl(aq) + H2O(l), ∆H = +50,4 kJ.mol−1
E. HCl(aq) + KOH(aq) → KCl(aq) + H2O(l), ∆H = +504 kJ.mol−1
Pembahasan
Semua persamaan reaksi pada pilihan jawaban di atas adalah sama. Kita tinggal mencari perubahan entalpinya.
Diketahui:
∆t = 6 °C
c = 4,2 J.g−1.K−1
ρ = 1 g.mL−1
Jumlah mol larutan adalah
mol = M.V
= 1 M × 100 mL
= 100 mmol
= 0,1 mol
Volume air yang terjadi merupakan volume total zat pereaksi.
V = 100 mL + 100 mL
= 200 mL
Sehingga massa air adalah
ρ = m/V
m = ρ.V
= 1 × 200
= 200 gram
Besar kalor pada reaksi tersebut adalah
Q = m.c.∆t
= 200 × 4,2 × 6 J
= 5040 J
= 5,04 kJ
Dengan demikian, perubahan entalpi reaksi tersebut adalah
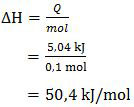
Karena terjadi kenaikan suhu, maka reaksi yang terjadi adalah reaksi eksoterm sehingga ∆H bernilai negatif, ∆H = −50,4 kJ.mol−1.
Jadi, persamaan termokimia yang paling tepat adalah (A).
Perdalam materi ini di Pembahasan Kimia UN: Termokimia.
Simak Pembahasan Soal Kimia UN 2016 selengkapnya.
Dapatkan pembahasan soal dalam file pdf di sini.
Terimakasih
Semoga Bermanfaat

