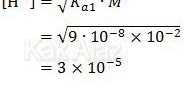pembahasan selanjutnya adalah
- pH asam dan basa,
- titrasi asam dan basa,
- hukum dasar kimia,
- larutan penyangga, serta
- hidrolisis garam.
Soal No. 11 tentang pH Asam dan Basa
H2S ⇄ H+ + HS− Ka1 = 9,0 × 10−8
HS− ⇄ H+ + S2− Ka2 = 1,2 × 10−15
pH asam sulfida adalah ….
A. 8 − log 9
B. 6 − log 3
C. 5 − log 9
D. 5 − log 3
E. 4 − log 3
Pembahasan
Asam lemah pada soal di atas bersifat diprotik atau mempunyai 2 harga Ka. Secara teori, harus dihitung dulu nilai [H+] untuk Ka1 dan Ka2 kemudian dijumlahkan. Namun, karena Ka2 nilainya sangat kecil (selisih 7 digit), maka dapat diabaikan.
Dengan demikian, secara praktis kita dapat menentukan pH asam lemah tersebut hanya dengan menggunakan Ka1.

Jadi, pH asam sulfida adalah 5 − log 3 (D).
Soal No. 12 tentang Titrasi Asam dan Basa
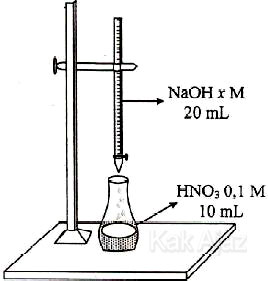
Titik akhir titrasi dicapai setelah penambahan 20 mL larutan NaOH (Ar Na = 23, O = 16, H =1). Massa NaOH(s) yang terlarut dalam 20 mL larutan NaOH tersebut adalah ….
A. 0,04 gram
B. 0,08 gram
C. 0,40 gram
D. 0,80 gram
E. 4,00 gram

Pembahasan
Titik akhir titrasi dirumuskan sebagai
M1 . V1 . n1 = M2 . V2 . n2
Indeks (1) mewakili basa NaOH dan indeks (2) mewakili asam HNO3. Sedangkan n1 dan n2 masing-masing adalah valensi basa dan valensi asam, yang kebetulan keduanya sama dengan 1. Gampangnya, n1 = jumlah OH dalam NaOH dan n1 = jumlah H dalam HNO3. Diperoleh:
M1 × 20 × 1 = 0,1 × 10 × 1
M1 = 0,05 M
Sekarang kita tentukan massa NaOH dengan rumus
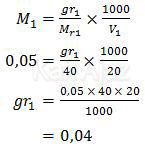
Jadi, massa NaOH(s) yang terlarut dalam 20 mL larutan NaOH tersebut adalah 0,04 gram (A).
Perdalam soal no. 11 dan 12 di Pembahasan Kimia UN: Asam dan Basa.
Soal No. 13 tentang Hukum Dasar Kimia
CH4(g) + O2(g) → CO2(g) + H2O(g)
Perbandingan volume gas-gas yang terlibat dalam reaksi menurut hukum Gay Lussac yang paling tepat adalah ….
| Volume Gas (L) | ||||
| CH4 | O2 | CO2 | H2O | |
| A. | 2 | 3 | 3 | 2 |
| B. | 1 | 2 | 2 | 1 |
| C. | 2 | 4 | 3 | 1 |
| D. | 3 | 6 | 3 | 6 |
| E. | 3 | 8 | 6 | 8 |
Pembahasan
Hukum Gay Lussac menyatakan bahwa volume gas-gas dalam suatu reaksi berbanding lurus dengan koefisien reaksinya. Hal ini berarti bahwa perbandingan volume gas sama dengan perbandingan koefisien reaksinya.
Dengan demikian, kita tinggal menyetarakan reaksi di atas menjadi
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
Berdasarkan reaksi setara di atas, diperoleh perbandingan koefisien
1 : 2 : 1 : 2
Perbandingan koefisien tersebut sama dengan perbandingan volumenya. Kita tinggal mencari pada pilihan jawaban, opsi mana yang sebanding dengan perbandingan koefisien di atas.
Setelah kita periksa, ternyata opsi D yang mempunyai perbandingan tersebut.
3 : 6 : 3 : 6 ≅ 1 : 2 : 1 : 2
Jadi, perbandingan volume gas-gas yang terlibat dalam reaksi di atas adalah 3 : 6 : 3 : 6 (D).
Perdalam materi ini di Pembahasan Kimia: Hukum Dasar Kimia.
Soal No. 14 tentang Larutan Penyangga
- H2C2O4
- H2PO4−
- H2CO3
- CO32−
- HPO42−
Pasangan spesi kimia yang dapat membentuk larutan penyangga adalah ….
A. (1) dan (2)
B. (2) dan (3)
C. (2) dan (5)
D. (3) dan (4)
E. (4) dan (5)
Pembahasan
Larutan penyangga mengandung campuran asam lemah dengan basa konjugasinya atau basa lemah dengan asam konjugasinya.
Dengan kata lain, kita cari pasangan spesi kimia di atas yang tersusun dari unsur yang sama tetapi jumlah H berbeda 1, yaitu:
H2PO4− dan HPO42−
H2PO4− bertindak sebagai asam lemah (jumlah H lebih banyak) sedangkan HPO42− bertindak sebagai basa konjugasinya.
Jadi, pasangan spesi kimia yang dapat membentuk larutan penyangga adalah nomor 2 dan 5 (C).
Perdalam materi ini di Pembahasan Kimia UN: Larutan Penyangga.
Soal No. 15 tentang Hidrolisis Garam
| Percobaan | CH3COOH | NaOH | ||
| Volume (mL) | Konsentrasi (M) | Volume (mL) | Konsentrasi (M) | |
| (1) | 50 | 0,1 | 50 | 0,1 |
| (2) | 50 | 0,2 | 50 | 0,2 |
| (3) | 100 | 0,4 | 100 | 0,4 |
Jika diketahui Ka CH3COOH = 1 × 10−5 maka urutan kenaikan pH campuran adalah ….
A. (3), (2), (1)
B. (3), (1), (2)
C. (2), (3), (1)
D. (1), (3), (2)
E. (1), (2), (3)
Pembahasan
Reaksi hidrolisis yang terjadi adalah
CH3COOH + NaOH → CH3COONa + H2O
Garam CH3COONa bersifat basa karena berasal dari asam lemah CH3COOH dan basa kuat NaOH sehingga rumus hidrolisisnya adalah
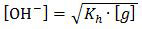
Kh adalah tetapan hidrolisis yang besarnya dapat dicari dengan rumus
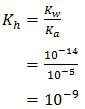
Sedangkan [g] adalah molaritas garam. Nilai [g] untuk tiap percobaan di atas adalah
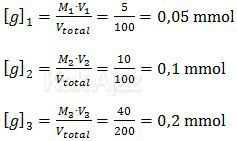
Dengan demikian, pH dari masing-masing percobaan di atas adalah
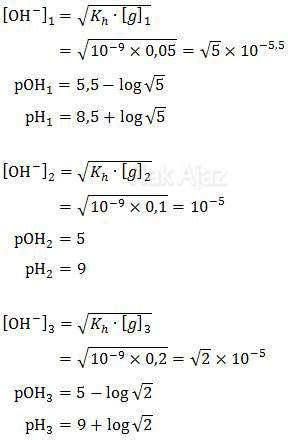
Jadi, urutan kenaikan pH campuran tersebut adalah 1, 2, dan 3 (E).
Perdalam materi ini di Pembahasan Kimia UN: Hidrolisis Garam.
Simak Pembahasan Soal Kimia UN 2016 selengkapnya.
Dapatkan pembahasan soal dalam file pdf di sini.
Terimakasih
Semoga Bermanfaat