pembahasan selanjutnya adalah
- struktur atom,
- sistem periodik unsur,
- jenis ikatan kimia, dan
- sifat ikatan kimia.
Soal No. 1 tentang Struktur Atom

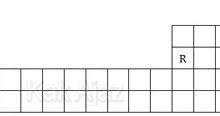
Konfigurasi elektron dan nomor atom dari unsur dalam tabel periodik tersebut yang benar adalah ….
| Unsur | Konfigurasi | Nomor Atom | |
| A. | P | [He] 2s2 | 5 |
| B. | Q | [He] 2s2 2p5 | 9 |
| C. | R | [Ne] 4s1 | 13 |
| D. | Y | [Ar] 4s1 | 18 |
| E. | T | [Ar] 4s1 | 40 |
Pembahasan
Kita tentukan dulu nomor atomnya.
Nomor 1 adalah kiri atas.
Nomor 2 adalah kanan atas.
Nomor 3 adalah P.
Kemudian diurutkan dari kiri ke kanan sehingga diperoleh nomor atom:
P = 3
Q = 9
R = 13
Y = 18
T = 20
Berdasarkan nomor atomnya, pilihan jawaban yang pasti salah adalah opsi A dan E. Sekarang kita tentukan konfigurasi elektronnya untuk opsi yang benar saja.
Konfigurasi elektron pada soal di atas disingkat dengan menggunakan lambang unsur gas mulia (kolom paling kanan) sehingga diperoleh:
9Q = 1s2 2s2 2p5
= [He] 2s2 2p5
13R = 1s2 2s2 2p6 3s2 3p1
= [Ne] 3s2 3p1
18Y = 1s2 2s2 2p6 3s2 3p6
= [Ar]
Jadi, konfigurasi elektron dan nomor atom yang benar adalah opsi (B).
Perdalam materi ini di Pembahasan Kimia UN: Struktur Atom.
Soal No. 2 tentang Sistem Periodik Unsur
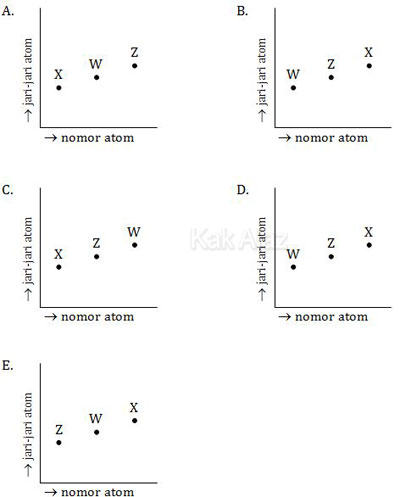
3X; 11Z; 19W
Gambar yang menunjukkan jari-jari atom ketiga unsur tersebut adalah ….

Pembahasan
Jika diperhatikan ketiga nomor atom unsur tersebut (3, 11, 19), ternyata ketiganya berselisih 8. Berarti ketiga unsur tersebut terletak dalam satu golongan.
Sifat jari-jari atom untuk unsur-unsur yang terletak dalam satu golongan adalah sebanding dengan nomor atomnya. Artinya, semakin besar nomor atom semakin besar pula jari-jari atomnya.
Pada soal di atas, semua opsi jawaban menunjukkan grafik naik. Berarti kita tinggal mencari urutan unsur yang nomor atomnya naik, yaitu X, Z, W.
Jadi, grafik yang menunjukkan jari-jari atom ketiga unsur tersebut adalah opsi (C).
Perdalam materi ini di Pembahasan Kimia UN: Sistem Periodik Unsur.
Soal No. 3 tentang Jenis Ikatan Kimia
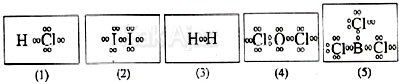
Senyawa yang tidak mengikuti kaidah oktet atau duplet adalah ….
A. (1)
B. (2)
C. (3)
D. (4)
E. (5)
Pembahasan
Suatu senyawa mengikuti kaidah oktet apabila elektron terluar tiap unsurnya berjumlah 8, termasuk elektron yang diikat. Sedangkan pada kaidah duplet elektron terluarnya berjumlah 2.
Pada soal di atas, hanya gambar nomor 5 yang tidak mengikuti kaidah oktet maupun duplet. Perhatikan gambar ilustrasi berikut ini.

Pada gambar di atas, tampak bahwa tiap unsur Cl telah memenuhi kaidah oktet karena mempunyai elektron terluar (termasuk elektron ikatan) berjumlah 8. Sedangkan unsur barium (B) hanya mempunyai elektron terluar berjumlah 6.
Jadi, senyawa yang tidak mengikuti kaidah oktet atau duplet adalah gambar nomor 5 (E).
Perdalam materi ini di Pembahasan Kimia UN: Jenis Ikatan Kimia.
Soal No. 4 tentang Sifat Ikatan Kimia
| Unsur | Keelektronegatifan |
| X | 4,0 |
| Y | 3,5 |
| Z | 3,0 |
| L | 2,8 |
| M | 2,1 |
Berdasarkan data tersebut, senyawa yang bersifat paling polar adalah ….
A. LX
B. MY
C. MZ
D. MX
E. LY
Pembahasan
Salah satu ciri senyawa yang bersifat pola adalah mempunyai beda keelektronegatifan tinggi. Sehingga untuk menentukan senyawa yang paling polar adalah dengan cara mencari selisih keelektronegatifan yang paling besar.
LX = 4,0 − 2,8 = 1,2
MY = 3,5 − 2,1 = 1,4
MZ = 3,0 − 2,1 = 0,9
MX = 4,0 − 2,1 = 1,9
LY = 3,5 − 2,8 = 0,7
Jadi, senyawa yang bersifat paling polar adalah MX (D).
Soal No. 5 tentang Sifat Ikatan Kimia
| Senyawa | Titik Leleh °C | Daya Hantar Listrik | |
| Lelehan | Larutan | ||
| P | −115 | tidak menghantarkan | menghantarkan |
| Q | 810 | menghantarkan | menghantarkan |
Berdasarkan data tersebut, jenis ikatan yang terdapat pada senyawa P dan Q berturut-turut adalah ….
A. ion dan kovalen nonpolar
B. kovalen polar dan kovalen nonpolar
C. kovalen polar dan ion
D. kovalen polar dan hidrogen
E. hidrogen dan ion
Pembahasan
Kunci soal di atas hanya terletak pada daya hantar listrik lelehan dan larutan. Perhatikan tabel berikut ini!
| Jenis Ikatan | Daya Hantar Listrik | |
| Lelehan | Larutan | |
| ion | + | + |
| kovalen polar | − | + |
| kovalen nonpolar | − | − |
Keterangan:
+ : menghantarkan listrik
− : tidak menghantarkan listrik
Jadi, jenis ikatan yang terdapat pada senyawa P dan Q adalah kovalen polar dan ion (C).
Perdalam materi soal no. 4 dan 5 di Pembahasan Kimia UN: Sifat Ikatan Kimia.
Simak Pembahasan Soal Kimia UN 2016 selengkapnya.
Dapatkan pembahasan soal dalam file pdf di sini.
Terimakasih
Semoga Bermanfaat