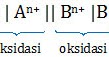pembahasan selanjutnya adalah
- sel elektrokimia,
- unsur radioaktif,
- kelimpahan unsur di alam,
- kimia unsur, serta
- pembuatan unsur dan senyawanya.
Soal No. 36 tentang Sel Elektrokimia
Fe2+ + 2e → Fe E° = −0,44 volt
Al3+ + 3e → Al E° = −1,66 volt
Zn2+ + 2e → Zn E° = −0,76 volt
Mg2+ + 2e → Mg E° = −2,37 volt
Cu2+ + 2e → Cu E° = +0,34 volt
Notasi sel yang tidak berlangsung spontan adalah ….
A. Fe | Fe2+ || Cu2+ | Cu
B. Zn | Zn2+ || Fe2+ | Fe
C. Mg | Mg2+ || Cu2+ | Cu
D. Al | Al3+ || Zn2+ | Zn
E. Cu | Cu2+ || Al3+ | Al
Pembahasan
Notasi sel pada reaksi spontan.

Mari kita urutkan terlebih dahulu unsur-unsur tersebut dari harga potensial sel terendah sampai tertinggi.
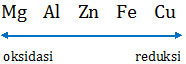
Unsur yang lebih kiri (E° lebih kecil) akan melakukan reaksi oksidasi sedangkan yang lebih kanan akan melakukan reduksi. Sekarang kita periksa masing-masing opsi.
A. Fe | Fe2+ || Cu2+ | Cu (spontan, karena Fe lebih kiri dari Cu)
B. Zn | Zn2+ || Fe2+ | Fe (spontan, karena Zn lebih kiri dari Fe)
C. Mg | Mg2+ || Cu2+ | Cu (spontan, karena Mg lebih kiri dari Cu)
D. Al | Al3+ || Zn2+ | Zn (spontan, karena Al lebih kiri dari Zn)
E. Cu | Cu2+ || Al3+ | Al (tidak spontan, karena Cu lebih kanan)
Jadi, notasi sel yang tidak berlangsung spontan adalah opsi (E).
Perdalam materi ini di Pembahasan Kimia UN: Reaksi Redoks dan Elektrokimia.
Soal No. 37 tentang Unsur Radioaktif
13Al27 + α → 15P30 + x
Partikel x yang dihasilkan pada persamaan reaksi inti tersebut adalah ….
A. proton
B. neutron
C. beta
D. positron
E. triton

Pembahasan
Untuk mengerjakan soal ini, kenali dulu jenis-jenis partikel radioaktif berikut.
- alfa : 2α4 atau 2He4
- beta : −1β atau −1e
- gamma : γ
- positron : +1β atau +1e
- neutron : n1
- proton : 1p1 atau 1H1
- deutron : 1H2
- triton : 1H3
Nah, sekarang kita gunakan nomor atom dan nomor massa partikel tersebut untuk reaksi inti berikut ini.
13Al27 + 2α4 → 15P30 + axb
Prinsip reaksi inti tersebut sederhana, jumlah nomor atom ruas kiri (13 + 2) sama dengan jumlah nomor atom ruas kanan (15 + a).
13 + 2 = 15 + a
15 = 15 + a
a = 0
Demikian juga jumlah nomor massa ruas kiri (27 + 4) sama dengan jumlah nomor massa ruas kanan (30 + b).
27 + 4 = 30 + b
31 = 30 + b
b = 1
Sehingga partikel x tersebut adalah
x1 (neutron)
Jadi, jadi partikel x yang dihasilkan pada reaksi tersebut adalah neutron (B).
Perdalam materi ini di Pembahasan Kimia UN: Unsur Radioaktif.
Soal No. 38 tentang Kelimpahan Unsur di Alam
| No. | Unsur | Mineral |
| 1. | Zn | Siderit |
| 2. | Mn | Pyrolusite |
| 3. | Ca | Gypsum |
| 4. | Al | Rutile |
Pasangan data yang keduanya berhubungan dengan tepat adalah ….
A. 1 dan 2
B. 1 dan 4
C. 2 dan 3
D. 2 dan 4
E. 3 dan 4
Pembahasan
Unsur-unsur yang disebutkan dalam soal adalah unsur logam beserta mineralnya. Ini soal hafalan murni. Sebaiknya dihafal data dalam tabel berikut.
| Unsur | Mineral |
| Na | senyawa chili |
| Mg | magnesit, kamalit, dolomit |
| Al | kaolin, bauksit, kriolit |
| Si | pasir silika, tanah liat |
| Ca | dolomit, fosfit, gipsum |
| Ti | rutile |
| Cr | kromit |
| Mn | pyrolusite, manganit |
| Fe | hematit, magnetit, pirit, siderit, limonit |
| Co | kobaltit |
| Ni | pentlandit |
Jadi, pasangan data yang keduanya berhubungan dengan tepat adalah nomor 2 dan 3 (C).
Perdalam materi ini di Pembahasan Kimia UN: Kelimpahan Unsur di Alam dan Pembuatannya.
Soal No. 39 tentang Kimia Unsur
- Unsurnya tidak terdapat bebas (murni) di alam.
- Mampu membentuk senyawa asam beroksigen lebih dari satu.
- Memiliki afinitas elektron yang besar.
- Sifat oksidatornya kuat.
Sifat tersebut dimiliki oleh unsur ….
A. halogen
B. golongan oksigen
C. golongan nitrogen
D. alkali
E. periode ketiga
Pembahasan
Penjelasan dari sifat unsur-unsur tersebut adalah sebagai berikut:
- Point 3 dan 4: memiliki afinitas besar dan oksidator kuat, menunjukkan bahwa unsur yang dimaksud terletak di sebelah kanan pada sistem periodik.
- Point 2: mampu membentuk senyawa asam beroksigen lebih dari satu, memastikan bahwa unsur yang dimaksud adalah golongan halogen. Halogen mampu membentuk asam oksihalida (HXOn), contoh: HClO (asam hipoklorit), HClO2 (asam klorit), HClO3 (asam klorat), dan HClO4 (asam perklorat).
- Point 1: tidak terdapat bebas di alam: lebih meyakinkan bahwa unsur yang dimaksud adalah golongan halogen. Unsur halogen adalah unsur-unsur yang reaktif dan selalu berusaha untuk berikatan, minimal dengan dirinya sendiri membentuk molekul diatomik, misal Cl2, atau bersenyawa dengan unsur lain, misal NaCl. Tak pernah kita temui unsur-unsur halogen jalan-jalan sendirian, Cl sendirian atau Br sendirian.
Jadi, yang memiliki sifat-sifat tersebut adalah unsur dari golongan halogen (A).
Perdalam materi ini di Pembahasan Kimia UN: Unsur Golongan Utama.
Soal No. 40 tentang Pembuatan Unsur dan Senyawanya
| No. | Lambang Unsur | Pembuatan | Kegunaan |
| 1. | Si | Hall-Heroult | semikonduktor |
| 2. | Fe | Goldschmidt | tulang beton |
| 3. | S | Frasch | koagulasi karet ban |
| 4. | Cl | Deacon | bahan pemutih |
| 5. | P | Down | pupuk |
Berdasarkan tabel tersebut, pasangan data yang benar adalah ….
A. 1 dan 2
B. 1 dan 3
C. 2 san 4
D. 3 dan 4
E. 4 dan 5
Pembahasan
Silakan dihafal tabel berikut ini.
| Nama Proses | Unsur atau Senyawa yang Dihasilkan |
| Sel Dawn Hall-Heroult Tanur Tiup Goldschmidt Kalsinasi Deacon, Weldon Frasch Haber-Bosch Wohler Kontak Oswald |
Natrium dan Magnesium Aluminium Besi Krom Logam Alkali Klorin Belerang Amonia Urea dan fosfor Asam sulfat Asam nitrat |
Jadi, pasangan data yang benar adalah nomor 3 dan 4 (D).
Perdalam materi ini di Pembahasan Kimia UN: Kelimpahan Unsur di Alam dan Pembuatannya.
Simak Pembahasan Soal Kimia UN 2015 selengkapnya.
Simak juga:
Pembahasan Kimia UN 2014
Pembahasan Kimia UN 2016
Pembahasan Kimia UN 2017
Pembahasan Kimia UN 2018
Pembahasan Kimia UN 2019
Dapatkan pembahasan soal dalam file pdf di sini.
Terimakasih
Semoga Bermanfaat