pembahasan selanjutnya adalah
- bentuk molekul,
- tata nama senyawa organik dan anorganik,
- persamaan reaksi sederhana,
- hukum dasar kimia, serta
- larutan elektrolit dan nonelektrolit.
Soal No. 6 tentang Bentuk Molekul
X : 1s2 2s2 2p6 3s2 3p3
Y : 1s2 2s2 2p5
Jika X dan Y membentuk senyawa XY3 maka bentuk molekulnya adalah ….
A. huruf T
B. segitiga datar
C. piramida segitiga
D. piramida segiempat
E. bipiramida segitiga
Pembahasan
Kita tentukan elektron valensi (elektron terluar) masing-masing unsur berdasarkan konfigurasi elektronnya.
X : 1s2 2s2 2p6 3s2 3p3 (5 elektron terluar)
Y : 1s2 2s2 2p5 (7 elektron terluar)
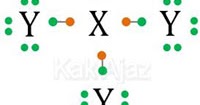
X dan Y membentuk senyawa XY3 berarti unsur X bertindak sebagai atom pusat yang bisa digambarkan

Perhatikan elektron valensi dari atom pusat X. Ada 3 elektron yang berpasangan dengan Y (m = 3) dan terdapat 1 pasang elektron bebas (n = 1). Sehingga tipe molekul untuk senyawa tersebut adalah
AXmEn
AX3E
Tipe molekul AX3E mempunyai bentuk molekul segitiga piramida.
Jadi, senyawa XY3 mempunyai bentuk molekul piramida segitiga (C).
Tabel tipe dan bentuk molekul serta soal-soal tentang bentuk molekul bisa disimak di Pembahasan Kimia UN: Bentuk Molekul
Soal No. 7 tentang Tata Nama Senyawa Organik dan Anorganik
| No. | Rumus Senyawa | Nama Senyawa |
| (1) | Na2S | dinatrium sulfida |
| (2) | K2O | kalium oksida |
| (3) | Al2O3 | dialuminium trioksida |
| (4) | N2O3 | dinitrogen trioksida |
| (5) | NaCl2 | natrium klorida |
Pasangan rumus dan nama senyawa yang benar adalah ….
A. (1) dan (2)
B. (2) dan 3)
C. (2) dan (4)
D. (3) dan (4)
E. (4) dan (4)

Pembahasan
Tata nama senyawa yang berasal dari logam golongan utama dan nonlogam, cukup dengan menyebutkan nama logam dan diikuti nama nonlogam degan akhiran −ida.
Na2S : natrium sulfida [pernyataan 1 salah]
K2O : kalium oksida [pernyataan 2 benar]
Al2O3 : aluminium oksida [pernyataan 3 salah]
Sedangkan NaCl2, penulisan rumus senyawanya salah. Mestinya NaCl karena Na golongan IA (bilangan oksidasinya 1).
NaCl : natrium klorida [pernyataan 5 salah]
Adapun N2O3 tersusun dari unsur nonlogam dan nonlogam serta mempunyai lebih dari 1 bentuk senyawa. Sehingga penamaannya mengikuti jumlah unsur dalam senyawa tersebut.
NO : nitrogen monoksida
NO2 : nitrogen dioksida
N2O : dinitrogen monoksida
N2O3 : dinitrogen trioksida [pernyataan 4 benar]
N2O5 : dinitrogen pentaoksida
Jadi, pasangan rumus dan nama senyawa yang benar adalah nomor 2 dan 4 (C).
Perdalam materi ini di Pembahasan Kimia UN: Tata Nama Senyawa Organik dan Anorganik.
Soal No. 8 tentang Persamaan Reaksi Sederhana
2C2H6(g) + 7O2(g) → 4CO2(g) + 6H2O(g)
Pernyataan yang benar tentang persamaan reaksi tersebut adalah ….
A. gas karbondioksida disebut pereaksi
B. 2 molekul gas etana merupakan hasil reaksi
C. angka 7 di depan O2 disebut indeks reaksi
D. gas karbondioksida dan uap air merupakan hasil reaksi
E. persamaan reaksi tersebut belum setara
Pembahasan
Ketentuan umum persamaan reaksi adalah sebagai berikut:
- Pereaksi atau reaktan adalah semua unsur dan senyawa yang terletak di ruas kiri, yaitu C2H6 (etana) dan O2 (gas oksigen). [opsi A salah]
- Hasil reaksi atau produk adalah semua unsur dan senyawa yang terletak di ruas kanan, yaitu CO2 (gas karbondioksida) dan H2O (uap air. [opsi B salah, opsi D benar]
- Koefisien reaksi adalah angka yang berada di depan unsur atau senyawa, contoh koefisien reaksi 7O2 adalah 7.
- Indeks reaksi adalah angka yang terletak di kanan bawah lambang unsur, contoh indeks reaksi 7O2 adalah 2. [opsi C salah]
- Suatu reaksi sederhana dikatakan setara apabila jumlah atom di ruas kiri sama dengan jumlah atom di ruas kanan. Reaksi di atas sudah setara. [opsi E salah]
Jadi, pernyataan yang benar tentang reaksi tersebut adalah opsi (D).
Perdalam materi ini di Pembahasan Kimia UN: Persamaan Reaksi Sederhana.
Soal No. 9 tentang Hukum Dasar Kimia
2S(s) + 2O2(g) → 2SO2(g)
Massa gas sulfur dioksida yang dihasilkan pada reaksi tersebut adalah … (Ar S = 32; O = 16).
A. 30 gram
B. 32 gram
C. 34 gram
D. 40 gram
E. 64 gram
Pembahasan
Mari kita periksa jumlah masing-masing pereaksi!
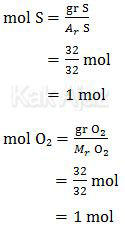
Karena jumlah mol S sama dengan jumlah O2 dan keduanya mempunyai koefisien reaksi yang sama maka reaksi tersebut dikatakan tepat bereaksi. Sehingga memenuhi hukum kekekalan massa (hukum Lavoisier).
Dengan demikian, massa sulfur oksida yang dihasilkan merupakan penjumlahan langsung dari massa pereaksinya.
massa SO2 = massa S + massa O2
= 32 gram + 32 gram
= 64 gram
Jadi, massa gas sulfur dioksida yang dihasilkan pada reaksi di atas adalah 64 gram (E)
Perdalam materi ini di Pembahasan Kimia UN: Hukum Dasar Kimia..
Soal No. 10 tentang Larutan Elektrolit dan Nonelektrolit
| No. | Pengamatan pada | |
| Elektroda | Lampu | |
| (1) | tidak ada gelembung | padam |
| (2) | sedikit gelembung | padam |
| (3) | sedikit gelembung | redup |
| (4) | banyak gelembung | redup |
| (5) | banyak gelembung | menyala |
Pasangan senyawa yang merupakan larutan elektrolit kuat dan nonelektrolit berturut-turut ditunjukkan oleh larutan nomor ….
A. (1) dan (3)
B. (2) dan (5)
C. (4) dan (5)
D. (5) dan (1)
E. (5) dan (3)
Pembahasan
Penentuan jenis larutan berdasarkan percobaan di atas adalah sebagai berikut:
- Larutan elektrolit kuat ditandai oleh nyala lampu terang dan banyak gelembung. [percobaan 5]
- Larutan nonelektrolit ditandai oleh lampu mati dan tidak ada gelembung. [percobaan 1]
- Larutan elektrolit lemah ditandai dengan adanya gelembung meskipun sedikit, sedangkan nyala lampu bisa terang, redup, atau bahkan padam. [percobaan 2, 3, dan 4]
Jadi, senyawa yang merupakan larutan elektrolit kuat dan nonelektrolit adalah nomor 5 dan 1 (D).
Perdalam materi ini di Pembahasan Kimia UN: Larutan Elektrolit dan Nonelektrolit.
Simak Pembahasan Soal Kimia UN 2016 selengkapnya.
Dapatkan pembahasan soal dalam file pdf di sini.
Terimakasih
Semoga Bermanfaat