pembahasan selanjutnya adalah
- sel elektrokimia,
- korosi,
- reaksi senyawa karbon, dan
- jenis reaksi senyawa karbon.
Soal No. 31 tentang Sel Elektrokimia

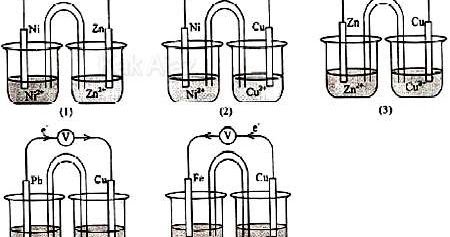
Nomor, notasi sel, harga E sel yang tepat adalah ….
| No. | Notasi Sel | Harga E | |
| A. | (1) | Zn|Zn2+||Ni2+|Ni | positif |
| B. | (2) | Cu| Cu2+||Ni2+|Ni | positif |
| C. | (3) | Zn| Zn2+||Cu|Cu2+ | positif |
| D. | (4) | Pb| Pb2+||Cu|Cu2+ | positif |
| E. | (5) | Fe| Fe2+||Cu|Cu2+ | positif |
Pembahasan
Bentuk umum notasi sel yang berlangsung spontan adalah

Berdasarkan bentuk umum tersebut, opsi jawaban yang pasti salah adalah opsi C, D, dan E.
Sekarang kita fokus ke gambar (1) dan (2).
Karena soal tidak menyebutkan harga potensial elektroda standar, maka kita harus mengingat kembali deret Volta berikut ini.

(Kalau Bapak Caesar Nanti Meninggal, Alam Mana Zaman Fer’aun, Nabi Sulaiman Pemberantas buta Huruf, Crupuk Hangus Agak Pait Auw)
Arti deret Volta tersebut adalah unsur yang terletak di sebelah kiri akan mengalami oksidasi sedangkan yang terletak di sebelah kanan akan mengalami reduksi.
Mari kita periksa gambar (1) dan (2)!
Terdapat elektroda Ni dan Zn. Dalam deret Volta, Zn terletak di sebelah kiri Ni sehingga Zn mengalami oksidasi dan Ni mengalami reduksi. Notasi selnya adalah
Zn | Zn2+ || Ni2+ | Ni
Terdapat elektroda Ni dan Cu. Dalam deret Volta, Ni terletak di sebelah kiri Cu sehingga Ni mengalami oksidasi dan Cu mengalami reduksi. Notasi selnya adalah
Ni | Ni2+ || Cu2+ | Cu
Jadi, nomor, notasi sel, harga E sel yang tepat adalah opsi (A).
Soal No. 32 tentang Korosi
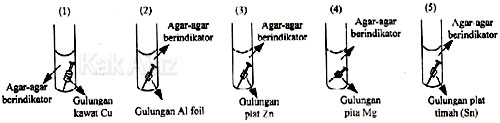
Paku yang paling lambat mengalami korosi adalah ….
A. (1)
B. (2)
C. (3)
D. (4)
E. (5)

Pembahasan
Perbedaan kelima gambar di atas hanya terletak jenis logam yang digunakan sebagai gulungan pada paku. Perlindungan korosi dengan cara menghubungkan dengan logam lain ini dikenal dengan istilah proteksi katodik.
Proteksi katodik akan efektif bila paku (Fe) dihubungkan dengan logam lain yang berada di sebelah kirinya pada deret Volta (lihat deret Volta pada pembahasan soal no. 31).
Mari kita perhatikan logam yang digunakan sebagai gulungan pada paku!
Cu, Al, Zn, Mg, Sn
Jika logam-logam tersebut kita diurutkan menurut deret Volta, diperoleh:
Mg, Al, Zn, (Fe), Sn Cu
Ternyata logam yang paling kiri adalah Mg. Dengan demikian Mg efektif memperlambat korosi bila digulungkan pada paku (Fe).
Jadi, paku yang paling lambat mengalami korosi adalah gambar nomor 4 (D).
Perdalam materi ini di Pembahasan Kimia UN: Korosi.
Soal No. 33 tentang Sel Elektrokimia
Zn2+ | Zn = −0,76 V
Fe2+ | Fe = −0,44 V
Pb2+ | Pb = −0,13 V
Cu2+ | Cu = +0,34 V
Ag+ | Ag = +0,80 V
Diagram sel yang berlangsung spontan adalah ….
A. Cu | Cu2+ || Zn2+ | Zn
B. Ag | Ag+ || Fe2+ | Fe
C. Ag | Ag2+ || Zn2+ | Zn
D. Pb | Pb2+ || Cu2+ | Cu
E. Pb | Pb2+ || Zn2+ | Zn
Pembahasan
Kita gunakan bentuk umum notasi sel seperti pembahasan soal no. 31.

Jika menggunakan deret Volta maka unsur di sebelah kiri akan mengalami oksidasi sedangkan sebelah kanan akan mengalami reduksi. Jika memanfaatkan data potensial reduksi di atas maka:
- oksidasi : E kecil
- reduksi : E besar
Mari kita periksa tiap opsi jawaban!
A: E Zn lebih kecil, seharusnya Zn mengalami oksidasi (terletak di depan)
B: E Fe lebih kecil, seharusnya Fe mengalami oksidasi
C: E Zn lebih kecil, seharusnya Zn mengalami oksidasi
D: E Pb lebih kecil, benar Pb mengalami oksidasi
E: E Zn lebih kecil, seharusnya Zn mengalami oksidasi
Jadi, diagram sel yang berlangsung spontan adalah opsi (D).
Perdalam soal no. 31 – 33 di Pembahasan Kimia UN: Reaksi Redoks dan Elektrokimia.
Soal No. 34 tentang Reaksi Senyawa Karbon
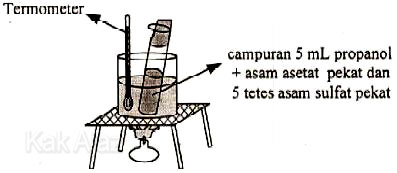
Senyawa yang dihasilkan dari reaksi tersebut adalah ….
A. metil propanoat
B. etil propanoat
C. etil pentanoat
D. propil pentanoat
E. propil etanoat
Pembahasan
Reaksi pada gambar di atas adalah reaksi antara golongan alkanol (alkohol) dengan golongan asam alkanoat (asam karboksilat). Reaksi ini dikenal dengan istilah reaksi esterifikasi atau reaksi pembentukan ester (alkil alkanoat).
alkanol + asam alkanoat → alkil alkanoat + air
Perhatikan reaksi di atas! Alkanol berubah menjadi gugus alkil pada ester. Dengan demikian, reaksi antara propanol dengan asam asetat (asam etanoat) akan menjadi:
propanol + asam etanoat → propil etanoat + air
Jadi, nama senyawa yang dihasilkan dari reaksi tersebut adalah propil etanoat (E).
Soal No. 35 tentang Jenis Reaksi Senyawa Karbon
- CH3-CH2OH → CH2=CH2 + H2O
- CH3-CH=CH2 + HCl → CH3-CHCl-CH3
- CH3-CH2Cl + CH3OK → CH2=CH2 + KCl + CH3-OH
- C2H5Cl + NaOH → C2H5OH + HCl
- CH≡C-CH3 + H2 → CH2=CH-CH3
Jenis reaksi substitusi ditunjukkan oleh persamaan reaksi ….
A. (1)
B. (2)
C. (3)
D. (4)
E. (5)
Pembahasan
Tiga jenis reaksi senyawa karbon yang perlu diketahui adalah:
- Reaksi eliminasi, yaitu reaksi pembentukan ikatan rangkap (rangkap tunggal menjadi rangkap dua atau rangkap dua menjadi rangkap tiga. [reaksi no. 1 dan 3]
- Reaksi adisi, yaitu reaksi pemutusan ikatan rangkap (rangkap dua menjadi tunggal atau rangkap tiga menjadi rangkap dua). [reaksi no. 2 dan 5]
- Reaksi substitusi, yaitu reaksi pertukaran atom atau gugus atom. [reaksi no. 4: pertukaran atom Cl dengan gugus OH]
Jadi, jenis reaksi substitusi ditunjukkan oleh persamaan reaksi nomor 4 (D).
Perdalam soal no. 34 dan 35 di Pembahasan Kimia UN: Senyawa Karbon.
Simak Pembahasan Soal Kimia UN 2016 selengkapnya.
Dapatkan pembahasan soal dalam file pdf di sini.
Terimakasih
Semoga Bermanfaat