pembahasan selanjutnya adalah

Pembahasan soal Kimia Ujian Nasional (UN) tahun 2019 nomor 26 sampai dengan nomor 30 tentang:
- sel elektrolisis,
- titrasi asam basa,
- percobaan titrasi asam basa,
- larutan penyangga, dan
- hidrolisis garam.
Soal No. 26 tentang Sel Elektrolisis

Pembahasan
Nikel akan mengendap pada cincin di katoda dengan reaksi:
Ni2+ + 2e → Ni
sehingga diperoleh n = 2.
Massa nikel yang mengendap dapat dihitung dengan memanfaatkan hukum I Faraday.

Jadi, massa nikel yang mengendap pada cincin tersebut adalah opsi (B).
Perdalam materi ini di Pembahasan Kimia UN: Sel Elektrolisis dan Hukum Faraday.
Soal No. 27 tentang Titrasi Asam Basa
Alasan yang paling tepat terkait dengan terjadinya perubahan warna pada saat titrasi adalah ….
| A. | volume HCl sama dengan volume NaOH |
| B. | NaOH bersifat basa kuat sehingga larutan HCl menjadi merah |
| C. | larutan indikator pp akan memberikan warna merah pada larutan asam |
| D. | pada saat volume NaOH berlebih maka larutan menjadi merah |
| E. | mol HCl = mol NaOH dan pH larutan > 8,5 |
Pembahasan
Hal-hal yang perlu diketahui tentang indikator fenolftalein antara lain:
- biasanya digunakan untuk titrasi asam-basa kuat
- mempunyai rentang pH 8,3 – 10,0
- pada larutan asam dan netral tidak berwarna, sedangkan pada larutan basa (pH 8,3 – 10) berwarna merah/merah muda [opsi C salah]
- pada larutan basa (pH > 10) warna merah semakin memudar dan akhirnya tak berwarna [opsi B dan D salah]
Tinggal opsi A dan E. Perhatikan grafik berikut ini!
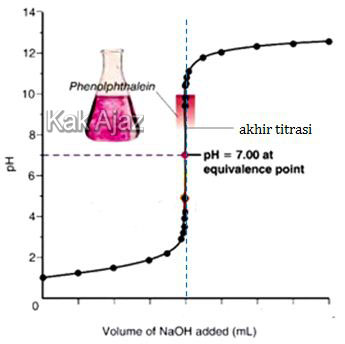
Titik akhir titrasi adalah saat indikator berubah warna dan titrasi harus dihentikan. Untuk titrasi HCl dengan NaOH, di titik tersebut volume HCl sama dengan volume NaOH sesuai rumus:
Ma Va na = Mb Vb nb
Pada soal, Ma = Mb. Sedangkan valensi HCl dan NaOH sama dengan satu sehingga Va = Vb. [opsi A benar]
Opsi E sebenarnya tidak salah. Cuma ada pernyataan pH larutan > 8,5 itu yang salah. Karena Va = Vb hanya terjadi sampai pH =10. Di atas itu volume basa sudah naik.
Jadi, alasan perubahan warna pada saat titrasi adalah opsi (A).
Perdalam materi ini di Pembahasan Kimia UN: Asam dan Basa.
Soal No. 28 tentang Percobaan Titrasi Asam-Basa

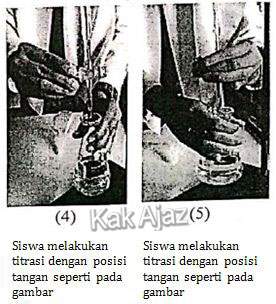
Berdasarkan gambar kegiatan siswa tersebut, teknik yang tepat untuk menuang larutan ke dalam biuret dan melakukan titrasi terdapat pada pasangan gambar nomor ….
A. (1) dan (4)
B. (1) dan (5)
C. (2) dan (5)
D. (3) dan (4)
E. (3) dan (5)

Pembahasan
Buret adalah alat laboratorium dari kaca berbentuk tabung memanjang. Salah satu ujungnya terbuka sedangkan ujung yang lain terdapat lubang kecil dan dilengkapi dengan kran pembuka/penutup. Salah satu fungsinya adalah untuk percobaan titrasi.
Untuk menuangkan larutan ke dalam buret dibutuhkan kehati-hatian dan teknik tertentu. Larutan tidak boleh dituangkan langsung ke dalam buret, tetapi harus menggunakan corong.

Corong yang dimasukkan ke dalam buret jangan terlalu rapat dengan mulut buret. Corong harus sedikit diangkat agar ada celah udara antara corong dan mulut buret. [gambar 2 benar]
Pada saat melakukan titrasi, kedua tangan harus bekerja. Tangan yang satu memegang gelas erlenmeyer sedangkan tangan yang lain memegang kran buffer seperti pada gambar di bawah ini.

Penggunaan tangan kanan/kiri bergantung kebiasaan. [gambar 2 benar]
Jadi, teknik menuang larutan ke dalam biuret dan melakukan titrasi yang tepat terdapat pada pasangan gambar nomor 2 dan 5 (C).
Perdalam materi ini di Pembahasan Kimia UN: Asam dan Basa.
Soal No. 29 tentang Larutan Penyangga
A. 4 – log 3
B. 4 – log 1,2
C. 5 – log 3
D. 5 – log 1,2
E. 6 – log 1,2
Pembahasan
Nilai mol untuk asam dan garam di atas adalah:
| mol C6H5COOH (na) | = | Ma .Va |
| = | 100 × 0,1 mmol | |
| = | 10 mmol | |
| mol C6H5COOK (ng) | = | Mg .Vg |
| = | 50 × 0,1 mmol | |
| = | 5 mmol |
Campuran asam lemah C6H5COOH dan garamnya C6H5COOK akan membentuk larutan penyangga. pH campuran ini dapat ditentukan melalui rumus:

Jadi, pH campuran kedua larutan tersebut adalah 4 – log 1,2 (B).
Perdalam materi ini di Pembahasan Kimia UN: Larutan Penyangga.
Soal No. 30 tentang Hidrolisis Garam

Data yang berhubungan dengan tepat ditunjukkan oleh pasangan nomor ….
A. (1) dan (3)
B. (2) dan (3)
C. (2) dan (4)
D. (3) dan (4)
E. (4) dan (5)
Pembahasan
Sifat garam bergantung pada asam/basa penyusunnya. Asam/basa kuat akan menentukan sifat keasaman (pH). Sedangkan asam/basa lemah akan terhidrolisis.
Mari kita periksa satu per satu kelima data di atas!
- Magnesium fluorida (MgF2) berasal dari basa lemah Mg(OH)2 dan asam lemah HF. Kedua ion (Mg2+ dan F−) mengalami hidrolisis. pH tergantung Ka dan Kb. [nomor 1 salah]
- Aluminium klorida (AlCl3) berasal dari basa lemah (amfoter) Al(OH)3 dan asam kuat HCl. Bersifat asam (pH < 7). Ion Al3+ mengalami hidrolisis. [nomor 2 benar]
- Kalium karbonat (K2CO3) berasal dari basa kuat KOH dan asam lemah H2CO3. Bersifat basa (pH > 7). Ion CO32− mengalami hidrolisis. [nomor 3 benar]
- Amonium sulfat (NH4)2SO4 berasal dari basa lemah NH4OH dan asam kuat H2SO4. Bersifat asam (pH < 7). Ion NH4+ mengalami hidrolisis [pernyataan 4 salah]
- Amonium asetat (CH3COONH4) berasal dari asam lemah CH3COOH dan basa lemah NH4OH. Kedua ion mengalami hidrolisis. pH tergantung Ka dan Kb. [nomor 5 salah]
Jadi, data yang berhubungan dengan tepat ditunjukkan oleh pasangan nomor 2 dan 3 (B).
Perdalam materi ini di Pembahasan Kimia UN: Hidrolisis Garam.
Simak Pembahasan Soal Kimia UN 2019 selengkapnya.
Dapatkan pembahasan soal dalam file pdf di sini.
Terimakasih
Semoga Bermanfaat
