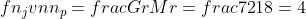Untuk Pembelajaran selanjutnya…
Soal No.1
Tiga puluh gram zat non-elektrolit dilarutkan dalam 72 gram air (Mr H2O = 18). Larutan tersebut memiliki penurunan tekanan uap sebesar 2 mmHg. Jika pada saat itu tekanan uap jenuh air adalah 18 mmHg, maka massa molekul relatif zat terlarut adalah….
PEMBAHASAN :
Diketahui:
Gr = 30 gram
P = 72 gram
ΔP = 2 mmHg
Po = 18 mmHg
Menentukan Tekanan Uap Larutan
ΔP = Po – PL
PL = Po – ΔP
PL = (18 – 2) mmHg = 16 mmHg
Menentukan Mr zat terlarut
3,55 + 0,89 nt = 4
0,89 nt = 4 – 3,55 = 0,45
Soal No.2
Diantara larutan berikut yang memiliki titik beku paling tinggi adalah….
- CH3COOH 0,2 m
- CO(NH2)2 0,2 m
- NaCl 0,2 m
- CaCl2 0,1 m
- Na3PO4 0,1 m
PEMBAHASAN :
Larutan yang memiliki titik beku paling tinggi adalah larutan yang memiliki penurunan titik beku yang paling rendah/kecil (berbanding terbalik). Untuk mengetahui larutan titik beku paling tinggi maka perlu dicari larutan yang penurunan titik bekunya paling kecil. Rumusan menentukan penurunan titik beku adalah sebagai berikut:
ΔTf = Kf.m.i
Karena pelarutnya sama, maka nilai Kf dapat diabaikan karena setiap pilihan jawaban memiliki nilai Kf yang sama
- CH3COOH 0,2 m
ΔTf = 0,2.2 = 0,4 (nilai i =2 dianggap sebagai elektrolit kuat walaupun elektrolit lemah) - CO(NH2)2 0,2 m
ΔTf = 0,2.1 = 0,2 (nilai i =1 karena non elektrolit) - NaCl 0,2 m
ΔTf = 0,2.2 = 0,4 (nilai i =2 karena elektrolit kuat dimana i = n atau jumlah ion) - CaCl2 0,1 m
ΔTf = 0,1.3 = 0,3 (nilai i = 3 karena elektrolit kuat dimana i = n atau jumlah ion) - Na3PO4 0,1 m
ΔTf = 0,1.4 = 0,4 (nilai i = 4 karena elektrolit kuat dimana i = n atau jumlah ion)
Maka larutan yang titik bekunya paling tinggi adalah pilihan B yaitu CO(NH2)2 0,2 m
Soal No.3
Diketahui titik beku larutan glukosa 1 m adalah -1,8oC. Tentukan titik beku larutan CaCl2 2 m
PEMBAHASAN :
Diketahui :
Tf larutan glukosa 1 m = -1,8oC
Menentukan titik beku larutan CaCl2 2 m melalui perbandingan
(i = 3 karena CaCl2 termasuk elektrolit kuat dimana i = n (jumlah ion)
ΔTf CaCl2 = 6 x -1,8 = -10,8
Larutan asam lemah biner 2 m mendidih pada suhu 101,46oC (Kb = 0,52 oC/m). Tentukan nilai derajat ionisasi asam lemah tersebut
PEMBAHASAN :
asam lemah biner (n= 2) memiliki titik didih larutannya 101,46oC maka kenaikan titik didihnya (ΔTb) = 101,46 – 100 = 1,46 oC
Menentukan derajat ionisasi
ΔTb = Kb.m.i = 0,52. 2. (1 + (n-1)α)
1,46 oC = 1,04 (1 + (2-1)α) = 1,04 (1 + α)
1,46 = 1,04 + 1,04α
1,04α = 1,46 – 1,04 = 0,42
Soal No.5
Sebanyak 200 mL larutan asam asetat (α = 0,25) 2 M pada suhu 27oC Tentukan besarnya tekanan osmosis(R = 0,082 L atm/ mol K)
PEMBAHASAN :
Diketahui:
V = 200 mL
α = 0,25
T = 27 oC = 300 K
R = 0,082 Latm/mol K
Menentukan tekanan osmosis
π = M.R.T.i = 2. 0,082. 300. (1+(2-1)0,25) = 49,2.(1 + 0,25) = 61,5 atm
Soal No.6
Suatu larutan dibuat dari pencampuran 45 gram C6H12O6, 15 gram CO(NH2)2, dan 200 gram air. Tentukan titik beku larutan tersebut (Ar C = 12, H = 1, O = 16, N = 14, Kf = 1,86 oC/m)
PEMBAHASAN :
diketahui:
Gr C6H12O6 = 45 gram
Gr CO(NH2)2 = 15 gram
Pair = 200 gram
Menentukan titik beku campuran
ΔTf = Kf.mcampuran.i
Maka titik beku larutan tersebut adalah:
ΔTf = Tfo – TfL = 0 – 4,65 oC = -4,65 oC
Soal No.7
Larutan sukrosa 0,35 M pada suhu tertentu isotonik dengan larutan NH4OH 0,25 M. Tentukan derajat ionisasi larutan basa lemah tersebut.
PEMBAHASAN :
isotonik merupakan keadaan dimana dua larutan memiliki tekanan osmosis yang sama
π1 = π2
(M.R.T.i)sukrosa = (M.R.T.i)NH4OH
Karena R.T nya sama maka dapat dicoret
M.i sukrosa = M. i NH4OH
0,35. 1 = 0,25. (1 + (n-1)α)
0,35 = 0,25. (1 + (2-1)α)
0,35 = 0,25 + 0,25 α
0,25 α = 0,1
Soal No.8
Sejumlah naftalena (C10H8) dilarutkan dalam 200 gram benzena (C6H6) dan mendidih pada suhu 80,73 oC. Jika titik didih benzena = 80,1 oC dan Kb benzena = 2,52 oC/m, Tentukan naftalena yang dilarutkan( Ar C = 12, H = 1)
PEMBAHASAN :
Diketahui:
P = 200 gram
TbL = 80,73 oC
Tbo = 80,1 oC
maka ΔTb = TbL – Tbo = 80,73 – 80,1 = 0,63 oC
Kb = 2,52 oC/m
Menentukan massa naftalena yang dilarutkan (Gr)
ΔTb = Kb.m
Soal No.9
Ke dalam 200 gram air dilarutkan 5,4 gram HCN dan membeku pada suhu -2,232oC. Jika Kf air = 1,86 oC/m, maka HCN yang terionisasi adalah….(Ar H = 1, C = 12, N = 14)
PEMBAHASAN :
Diketahui:
P = 200 gram
Gr = 5,4 gr
TfL = -2,232 oC
Kf = 1,86 oC/m
Menentukan jumlah HCN yang terionisasi (α)
ΔTf = Kf. m. i
1,2 = 1 + α
α = 1,2 – 1 = 0,2 x 100% = 20%
Soal No.10
Diketahui titik beku larutan 0,1 m KCl dalam air adalah -0,36 oC. Maka titik beku larutan BaCl2 0,02 m adalah….
PEMBAHASAN :
Diketahui :
Titik beku KCl 0,1 m = -0,36 oC
Menentukan titik beku BaCl2 bisa melalui perbandingan:
Karena Kf nya sama maka dapat dihilangkan
ΔTf BaCl2 = 0,108
Titik bekunya :
ΔTf = Tfo – TfL
TfL = Tfo – ΔTf = 0 – 0,108 = – 0,108 oC
Semoga Bermanfaat