Untuk Pembelajaran selanjutnya…
Sistem dan Lingkungan
Sistem : Segala sesuatu yang menjadi pusat perhatian/ pengamatan.
Lingkungan : Bagian di luar sistem.
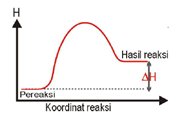
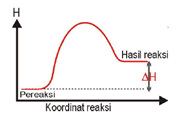
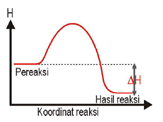
Perbedaan Reaksi Endoterm & Eksoterm
|
Reaksi Endoterm |
Reaksi Eksoterm |
|
Terjadi perpindahan kalor dari lingkungan ke sistem (sistem menyerap kalor dari lingkungan). |
Terjadi perpindahan kalor dari sistem ke lingkungan (sistem melepas kalor ke lingkungan). |
| ΔH = + atau ΔH > 0 |
ΔH = – atau ΔH < 0 |
 |
 |
Perubahan Entalpi Standar (ΔH)
Perubahan entalpi pembentukan standar (ΔHf)
Perubahan entalpi yang terjadi pada pembentukan 1 mol suatu senyawa dari unsur-unsurnya yang paling stabil.
Unsur-unsur stabil :
| Monoatomik | Diatomik | Poliatomik |
| Gol I A, Gol, IIA, Gol Transisi, C, Pb, S | F2, Cl2, Br2, I2, H2, O2, N2 | P4, S8 |
Contoh pembentukan air:
H2 (g) + ½O2 (g) → H2O (l) ΔH = -285,5 kJ
Perubahan entalpi penguraian standar (ΔHd)
Perubahan entalpi yang terjadi pada penguraian 1 mol suatu senyawa menjadi unsur-unsurnya yang paling stabil. Contoh Penguraian C2H6 :
C2H6 (g) → 2C (s) + 3 H2 (g) ΔH = -x kJ
Perubahan entalpi pembakaran standar (ΔHc)
Perubahan entalpi yang terjadi pada pembakaran 1 mol suatu senyawa menjadi CO2 (pembakaran sempurna)/CO(pembakaran tidak sempurna) dan H2O. Contoh Pembakaran CH4
CH4(g) + 4O2 (g)→ CO2 (g) + 2H2O (l) ΔH = +x kJ
Persamaan Termokimia
Persamaan reaksi yang menunjukkan informasi DH . Didalam persamaan termokimia :
Koefisien = Mol
Contoh :
H2 (g) + ½ O2 (g) → H2O (l) ΔH = -285,5 kJ
Dibaca :
1 mol gas hidrogen bereaksi dengan ½ mol gas oksigen menghasilkan air dengan melepaskan kalor sebesar 285,5 kJ
Perhitungan Persamaan Termokimia Berlaku :
- Jika reaksi dibalik, nilai ΔH berubah tanda dari + ke – dan sebaliknya.
- Jika reaksi dikali x, maka nilai ΔH dikali x.
- Jika reaksi dibagi x, maka nilai ΔH dibagi x.
Perhitungan ΔH
Cara 1 : Percobaan
qreaksi = – (qsistem + qkalorimeter)
qsistem = m . c . ΔT
qkalorimeter = C . ΔT
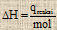
m = massa zat (gram)
c = kalor jenis (J/g C)
C = kapasitas jenis (J/C)
ΔT = Perubahan suhu
Cara 2 : Hukum Hess
Dikemukakan oleh Germain Henry Hess. Menurut Hukum Hess:
Kalor reaksi pada suatu reaksi tidak bergantung pada jalannya reaksi, tetapi hanya bergantung pada keadaan awal dan akhir reaksi
Atau
Perubahan entalpi suatu reaksi tetap sama, baik
berlangsung dalam satu tahap maupun beberapa tahap
Cara 3 : Penentuan ΔHreaksi dari data ΔHf
Penentuan ΔHreaksi dari data ΔHf dapat ditentukan dengan rumus:
ΔHreaksi = (ΣΔHf produk – ΣΔHf pereaksi)
Contoh :
pA + qB ® rC + sD DHr = ……?
ΔHreaksi = (ΔHf C x r + ΔHf D x s)–(ΔHf A x p + ΔHf B x q)
Cara 4 : Penentuan ΔHreaksi dari data Energi Ikatan
Penentuan ΔHreaksi dari data energi ikatan dapat ditentukan dengan rumus:
ΔHreaksi = (Energi total pemutusan ikatan – Energi total pembentukan ikatan)
- Part 1
- Part 2
- Part 3
- Part 4
Soal Essay Termokimia
Soal No.1
Jelaskan pengertian sistem dan lingkungan
PEMBAHASAN :
Sistem adalah segala sesuatu yang menjadi pusat perhatian, sedangkan Lingkungan yaitu hal-hal di luar sistem yang membatasi sistem dan dapat mempengaruhi sistem
Soal No.2
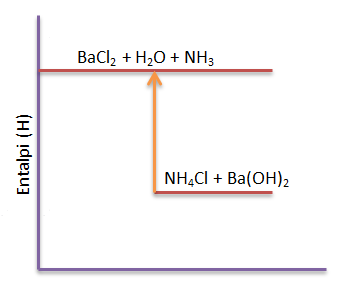
Di dalam gelas kimia direaksikan amonium klorida padat dengan barium hidroksida padat sehingga dihasilkan barium klorida, air, dan gas amonia. Pada reaksi tersebut ternyatasuhu sistem turun dari 25oC menjadi 12oC
Dari fakta tersebut:
- Tunjukkan manakah yang menjadi sistem dan lingkungannya
- Temukan apakah reaksi termasuk reaksi endoterm atau eksoterm
- Buatlah diagram tingkat energinya
PEMBAHASAN :
- Sistem : Amonium klorida, barium hidroksida, barium klorida, air dan gas amonia, Lingkungan : Gelas kimia
- Karena terjadi penurunan suhu sistem maka reaksi termasuk reaksi endoterm.
- diagram tingkat energi
Soal No.3
Jika arang (karbon) dibakar dengan oksigen menjadi gas karbondioksida, akan dilepaskan kalor sebesar 393,5 kJ/mol. Tuliskan persamaan termokimianya dan diagram energinya
PEMBAHASAN :
Persamaan Termokimia:
C(s) + O2(g) → CO2(g) ∆H = -393,5 kJ/mol
Diagram energi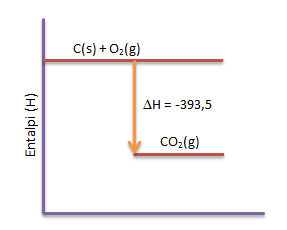
Soal No.4
Tuliskan persamaan termokimia dari pernyataan berikut
a. ∆Hfo CaCO3(s) = -1.207 kJ/mol
b. ∆Hco CH3OH(l) = -638 kJ/mol
PEMBAHASAN :
a. Ca(s) + C(s) + 3/2 O2(g) → CaCO3(s) ∆H = -1.207 kJ/mol
b. CH3OH(l) + O2 (g) → CO2(g) + H2O(l) ∆H = -638 kJ/mol
Soal No.5
Pada pembakaran 1,6 gram gas metana (CH4) dibebaskan kalor 80,2 kJ. Tentukan ∆Hco CH4 dan tuliskan persamaan termokimianya (Ar C = 12, H = 1)
PEMBAHASAN :
menentukan jumlah mol CH4![]()
0,1 mol CH4 melepaskan 80,2 kJ, ditanyakan ∆Hco (1 mol) dihitung melalui perbandingan![]()
Persamaan termokimianya:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l)
Soal No.6
Pada peruraian gas amonia menjadi gas hidrogen dan gas nitrogen diperlukan kalor 46 kJ tiap mol amonia. Tentukan ∆Hfo gas amonia dan tuliskan persamaan termokimianya
PEMBAHASAN :
Reaksi peruraian amonia:
NH3(g) → ½ N2(g) + 3/2 H2(g) ∆H = +46 kJ/mol
Yang ditanyakan adalah ∆Hfo yaitu reaksi pembentukan standar yang merupakan kebalikan dari reaksi peruraian, sehingga nilai ∆H nya menjadi kebalikannya atau ∆Hfo = -46 kJ/mol, persamaan termokimianya:
½ N2(g) + 3/2 H2(g) → NH3(g) ∆H = -46 kJ/mol
Soal No.7
Ke dalam kalorimeter sederhana direaksikan 25 mL larutan H2SO4 0,5 M dan 25 mL KOH 1,0 M pada suhu 23,5 oC. Ternyata, temperaturnya naik menjadi 30,17 oC. Hitunglah perubahan entalpi reaksi yang terjadi. (Anggaplah bahwa massa jenis larutan 1 g/mL dan kalor jenis larutan 4,2 J/g K)
PEMBAHASAN :
qreaksi = -(qlarutan + qkalorimeter)
Karena kalor kalorimeter diabaikan, maka:
qreaksi = -qlarutan
massa larutan = ρlarutan.Vtotal= 1.(25+25) = 50 gram
∆T = (30,17 – 23,5)oC = (303,17 – 296,5) K = 6,67 K
qlar = mlar x c x ∆T
qlar = 50 gram x 4,2 J/g K x 6,67 K = 1400,7 J = 1,4 kJ
mol H2SO4 = 25 mL x 0,5 M = 12,5 mmol
mol KOH = 25 mL x 1 M = 25 mmol
mencari mol H2O
H2SO4 + 2KOH → K2SO4 + 2H2O
m 12,5 25 — —
r 12,5 25 – 12,5 25 +
s – — 12,5 25
mol H2O = 25 mmol = 2,5 x 10-2 mol
maka untuk 1 mol H2O![]()
Soal No.8
Asam benzoat murni (∆Hc C6H5COOH = -3.277 kJ/mol) sebanyak 1,22 gram (saya koreksi) dimasukkan ke dalam kalorimeter bom yang berisi 1.200 g air (kapasitas kalor kalorimeter = 1.365 J/oC; kalor jenis air 4,18 J/g oC). Hitunglah kenaikan suhu kalorimeter yang terjadi. (Ar C = 12, O = 16, H = 1)
PEMBAHASAN :
menentukan mol asam benzoat![]()
qreaksi = ∆H x mol = -3.277 kJ/mol x 0,01 mol = -32,77 kJ = -32.770 J
qreaksi = -(qlarutan + qkalorimeter)
qreaksi = -(m.c.∆T + C.∆T)
-32.770 J = – (1200.4,18.∆T + 1.365.∆T)
32.770 J = 6381.∆T
∆T = 5,13
Soal No.9
ke dalam suatu kalorimeter direaksikan 50 cm3 larutan CuSO4 0,1 M dengan serbuk seng (massa seng diabaikan). Ternyata, termometer menunjukkan kenaikan suhu 9 oC. Jika kalor jenis larutan dianggap 4,2 J/g K dan massa jenis larutan 1 g/cm3, tentukan ∆H dari reaksi: CuSO4 + Zn → Cu + ZnSO4
PEMBAHASAN :
massa larutan = ρ.V = 1 x 50 cm3 = 50 gram
qreaksi = -(qlarutan + qkalorimeter)
Karena kalor kalorimeter diabaikan, maka:
qreaksi = -qlarutan
qreaksi = m.c.∆T
qreaksi = 50.4,2.9 = 1890 J = 1,89 kJ
mol CuSO4 = 0.05 L x 0,1 M = 0,005 mol
∆H = qreaksi/mol = 1,89 kJ/0,005 mol = 378 kJ/mol
Soal No.10
Sebanyak 9,6 gram kristal LiOH ditambahkan ke dalam kalorimeter yang berisi 150 gram air. Setelah kristal LiOH larut, suhu kalorimeter beserta isinya naik dari 27 oC menjadi 33,5 oC. Tentukan entalpi pelarutan LiOH dalam air. (Kalor jenis larutan = 4,2 J/goC dan kapasitas kalor kalorimeter = 11,7 J/oC)
PEMBAHASAN :
qreaksi = -(qlarutan + qkalorimeter)
qreaksi = -(m.c.∆T + C.∆T)
qreaksi = -((9,6+150).4,2.(33,5-27) + 11,7.(33,5-27))
qreaksi = -4433,13 J
menentukan mol LiOH![]()
menentukan ∆H LiOH untuk 1 mol![]()
Soal No.11
Pembakaran sempurna 4 gram metana membentuk gas karbon dioksida dan air pada keadaan standar menghasilkan 55,625 kJ. Tentukan entalpi pembakaran molar standar metana
PEMBAHASAN :
menghitung jumlah mol metana![]()
untuk 1 mol (entalpi pembakaran molar standar)![]()
Soal No.12
2P(s) + O2(g) + 3Cl2(g) → 2POCl3(g) ∆H = -1.150 kJ
H2(g) + Cl2(g) → 2HCl(g) ∆H = -184 kJ
2P(s) + 5Cl2(g) → 2PCl5(g) ∆H = -640 kJ
2H2(g) + O2(g) → 2H2O(g) ∆H = -482 kJ
Hitunglah ∆H untuk reaksi:
PCl5(g) + H2O(g) → POCl3(g) + 2HCl(g)
PEMBAHASAN :
Untuk mencari ∆H melalui hukum Hess dalam bentuk reaksi yaitu cari patokan yaitu zat yang ada muncul satu kali di reaksi-reaksi yang diketahui ∆H nya. Patokan untuk soal ini adalah PCl5, H2O, POCl3, HCl. Kemudian sesuaikan reaksi diketahui sesuai dengan posisi dan jumlah patokan yang ada di reaksi yang ditanyakan, kemudian reaksi dijumlahkan (Jika ada yang sama di kiri dan kanan bisa di coret)sehingga menjadi:
Reaksi I (dibagi 2) : P(s) + ½ O2(g) + 3/2Cl2(g) → POCl3(g) ∆H = -575 kJ
Reaksi II (Tetap) : H2(g) + Cl2(g) → 2HCl(g) ∆H = -184 kJ
Reaksi III (Dibalik & Dibagi 2) : PCl5 → P(s) + 5/2 Cl2(g) ∆H = +320 kJ
Reaksi IV (Dibalik & Dibagi 2) : H2O(g) → H2(g) + ½ O2(g) ∆H = +241 kJ +
PCl5(g) + H2O(g) → POCl3(g) + 2HCl(g) ∆H = -198 kJ
Soal No.13
Diketahui:
∆Hfo H2O(l) = -285,5 kJ/mol
∆Hfo CO2(g) = -393,5 kJ/mol
∆Hfo C3H8(g) = -103 kJ/mol
- Hitunglah ∆Hc C3H8
- Berapa kalor yang dilepaskan jika 10 gram C3H8 dibakar sempurna (Ar C = 12, H = 1)
PEMBAHASAN :
- Jika diketahui data ∆Hfo maka penentuan ∆Hreaksi bisa dicari melalui rumus:
∆Hr = (S∆Hfo produk x koefisien) – (S∆Hfo pereaksi x koefisien)
Reaksi ∆Hc C3H8 yaitu :
C3H8(g) + 5O2(g) → 3CO2(g) + 4H2O(l)
∆Hr = (∆Hfo CO2 x 3 + ∆Hfo H2O x 4) – (∆Hfo C3H8 x 1 + ∆Hfo O2 x 5)
∆Hr = (-393,5 x 3 + -285,5 x 4) – (-103 + 0)
∆Hr = -2219,5 kJ/mol - menghitung jumlah mol C3H8
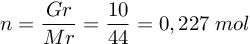
maka ∆Hr nya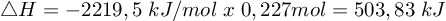
Soal No.14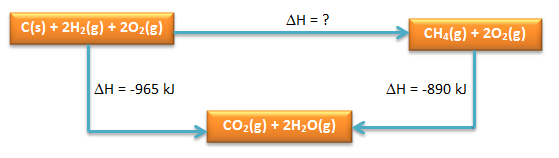
Hitunglah:
a. ∆Hfo CH4(g)
b. Buatlah diagram tingkat energinya
PEMBAHASAN :
- menentukan ∆Hfo CH4(g) kita lihat kembali diagramnya
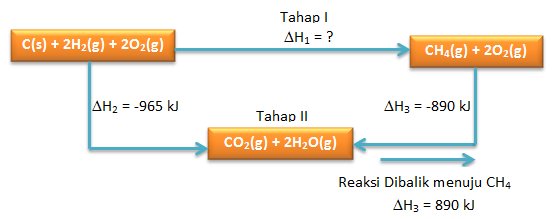
∆Hfo CH4 dapat ditentukan melalui hukum Hess
Dimisalkan ∆Hfo CH4 yaitu ∆H1 (Tahap I) dan reaksi yang diketahui sebagai ∆H2 dan ∆H3 (Tahap II)
dimana berlaku:
Tahap I = Tahap II
∆H1 = ∆H2 + ∆H3
∆H1 = -965 + 890
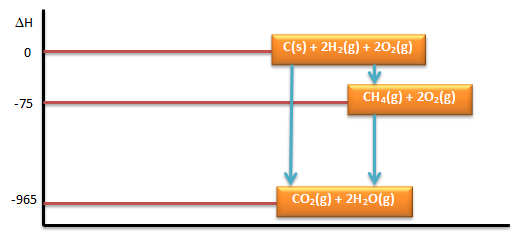
∆H1 = ∆Hfo CH4 = -75 kJ/mol - Diagram Tingkat Energinya
Soal No.15
Jika spiritus dianggap hanya mengandung alkohol (C2H5OH) saja, berapa gram spiritus harus dibakar untuk menaikkan suhu 100 gram air dari 20 oC menjadi 50 oC? (Dianggap hanya 50% saja kalor yang terpakai)
Diketahui:
∆Hfo H2O(g) =-240 kJ/mol
∆Hfo CO2(g) =-394 kJ/mol
∆Hfo C2H5OH(g) =-277 kJ/mol
Ar C = 12, H = 1, O = 16
PEMBAHASAN :
menghitung kalor yang diperlukan untuk memanaskan air
qreaksi = -(qlarutan + qkalorimeter)
Karena kalor kalorimeter diabaikan, maka:
qreaksi = -qlarutan
qreaksi = -(m.c.∆T)
qreaksi = -(100.4,2.30) = -12600 J = -12,6 kJ
menghitung ∆Ho C2H5OH
reaksi pembakaran C2H5OH
C2H5OH + 3O2 → 2CO2 + 3H2O
∆Hr = (∆Hfo CO2 x 2 + ∆Hfo H2O x 3) – (∆Hfo C2H5OH x 1 + ∆Hfo O2 x 3)
∆Hr = (-394 x 2 + -240 x 3) – (-277 + 0)
∆Hr = -1231 kJ/mol
kalor yang dilepaskan oleh spiritus adalah 2 x -12,6 kJ = -25,2 kJ karena 12,6 itu hanya 50% dari keseluruhan kalor yang dilepaskan
Jadi jumlah mol spiritus adalah![]()
![]()
Gr C2H5OH = n x Mr = 0,02 x 46= 0,92 gram
Soal No.16
Diketahui:
∆Hfo CO2(g) =-394 kJ/mol
∆Hfo H2O(g) =-285 kJ/mol
∆Hfo C2H4(g) =+52 kJ/mol
Hitunglah kalor yang dilepas pada pembakaran 6,72 liter gas C2H4 pada suhu 0oC, 1 atm (Ar C = 12, H = 1)
PEMBAHASAN :
menghitung ∆Ho C2H4
reaksi pembakaran C2H4
C2H4 + 3O2 → 2CO2 + 2H2O
∆Hr = (∆Hfo CO2 x 2 + ∆Hfo H2O x 2) – (∆Hfo C2H4OH x 1 + ∆Hfo O2 x 3)
∆Hr = (-394 x 2 + -285 x 2) – (+52 + 0)
∆Hr = -1410 kJ/mol
menghitung jumlah mol C2H4 dalam keadaan STP![]()
maka:
∆H = -1410 kJ/mol x 0,3 mol = -423 kJ
Soal No.17
Diketahui ∆Hfo CaCO3(s) = -1.207 kJ/mol, ∆Hfo CaO(s) = -635,5 kJ/mol, dan ∆Hfo CO2(g) = -394 kJ/mol
Tentukan perubahan entalpi pada proses peruraian CaCO3 dengan reaksi:
CaCO3(s) → CaO(s) + CO2(g)
PEMBAHASAN :
∆Hr = (∆Hfo CO2 x 1 + ∆Hfo CaO x 1) – (∆Hfo CaCO3 x 1)
∆Hr = (-394 x 1 + -635,5 x 1) – (-1.207)
∆Hr = 177,5 kJ/mol
Soal No.18
Diketahui:
HCN(aq) → H+(aq) + CN—(aq) ∆H = +42,8 kJ
H2O (l) → H+(aq) + OH—(aq) ∆H = +53,2 kJ
Hitunglah ∆H dari reaksi : HCN(aq) + OH—(aq) → H2O(l) + CN—(aq)
PEMBAHASAN :
Reaksi 1 (tetap) : HCN(aq) → H+(aq) + CN—(aq) ∆H = +42,8 kJ
Reaksi 2 (dibalik) : H+(aq) + OH—(aq) → H2O (l) ∆H = -53,2 kJ +
Sehingga : HCN(aq) + OH—(aq) → H2O(l) + CN—(aq) ∆H = -10.4 kJ
Soal No.19
Diketahui persamaan termokimia sebagai berikut.
C4H9OH(l) + 6O2(g) → 4CO2(g) + 5H2O(g) ∆H = -2.456 kJ
(C2H5)2O(l) + 6O2 → 4CO2(g) + 5H2O(g) ∆H = -2.510 kJ
Hitunglah perubahan entalpi untuk reaksi:
(C2H5)2O(l) → C4H9OH(l)
PEMBAHASAN :
Reaksi 1 (dibalik) : 4CO2(g) + 5H2O(g) → C4H9OH(l) + 6O2(g) ∆H = +2.456 kJ
Reaksi 2 (tetap) : (C2H5)2O(l) + 6O2 → 4CO2(g) + 5H2O(g) ∆H = -2.510 kJ +
Sehingga : (C2H5)2O(l) → C4H9OH(l) ∆H = -54 kJ
Soal No.20
Perhatikan siklus Hess berikut.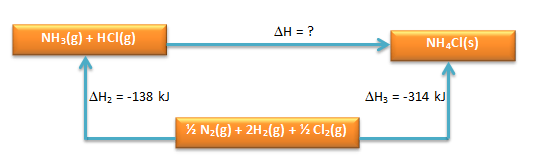
Dari siklus Hess di atas, hitunglah nilai perubahan entalpi reaksi:
NH3 + HCl(g) → NH4Cl(s)
PEMBAHASAN :
perhatikan kembali siklusnya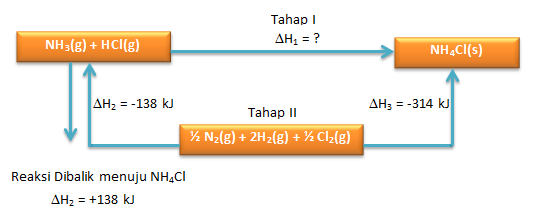
Dimisalkan ∆Hreaksi NH3(g) + HCl(g) → NH4C(s) yaitu ∆H1 (Tahap I) dan reaksi yang diketahui sebagai ∆H2 dan ∆H3 (Tahap II)
dimana berlaku:
Tahap I = Tahap II
∆H1 = ∆H2 + ∆H3
∆H1 = +138 kJ + (-314) kJ
∆H1 = -176 kJ/mol
Soal No.21
Diketahui C2H4(g) → 2C(g) + 4H(g) ∆H = +2.266 kJ dan energi ikatan rata-rata C-H = 413 kJ/mol. Hitunglah energi iakatan rata-rata C=C
PEMBAHASAN :
Struktur ikatannya adalah: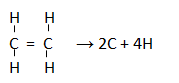
∆H = (∑pemutusan ikatan) – (∑penggabungan ikatan)
∆H = ( C=C + 4xC-H) – (0)
+2.266 = ( C=C + 4×413)
C=C = 2.266 – 1652 = +614 kJ/mol
Soal No.22
Jika Diketahui energi ikatan S-O = 469 kJ/mol, S=O = 323 kJ/mol, dan O=O = 495 kJ/mol, hitunglah perubahan entalpi dari reaksi berikut:
SO2(g) + 1/2 O2(g) → SO3(g)
PEMBAHASAN :
Struktur ikatannya adalah: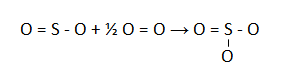
∆H = (∑pemutusan ikatan) – (∑penggabungan ikatan)
∆H = ( S=O + S – O + ½ O=O) – (S=O + 2xS-O)
∆H = ( 323 + 469 + ½ . 495) – (323 + 2×469)
∆H = (1039,5) – (1261) = -221,5 kJ/mol
Soal No.23
Jika diketahui energi ikatan rata-rata H-H = 436 kJ/mol, Br-Br = 192 kJ/mol dan H-Br = 366 kJ/mol, hitunglah ∆Hfo HBr.
PEMBAHASAN :
Reaksi pembentukan HBr adalah:
½ H2(g) + ½ Br2(g) → HBr(l)
Struktur ikatannya:
½ H-H + ½ Br-Br → H-Br
∆H = (∑pemutusan ikatan) – (∑penggabungan ikatan)
∆H = ( ½ H-H + ½ Br-Br) – (H-Br)
∆H = ( ½.436 + ½.192) – (366)
∆H = (314) – (366) = -52 kJ/mol
Soal No.24
Diketahui:
∆Hfo CO2(g) = -394 kJ/mol
∆Hfo H2O(g) = -285 kJ/mol
∆Hco CH4(g) = -802 kJ/mol
Energi ikatan rata-rata H-H = 436 kJ/mol
Energi atomisasi C(s) → C(g) ∆H = +715 kJ
Tentukan energi ikatan C-H pada CH4
PEMBAHASAN :
Reaksi pembentukan H2O
½ H2 + ½ O2 → H2O ∆H = -285 kJ/mol
Struktur ikatannya:
½ H-H + ½ O=O → H-O-H
∆H = (∑pemutusan ikatan) – (∑penggabungan ikatan)
∆H = ( ½ H-H + ½ O=O) – (H-Br)
-285 = ( ½.436 + ½.O=O) – (2xO-H)
2xO-H = 503 + ½ O=O
Reaksi pembentukan CO2
C + O2 → CO2 ∆H = -394 kJ/mol
Struktur ikatannya:
C + O=O → O=C=O
∆H = (∑pemutusan ikatan) – (∑penggabungan ikatan)
∆H = ( C + O=O) – (2xC=O)
-394 = ( 715 + O=O) – (2xC=O)
2xC=O = 1109 + O=O
Reaksi pembakaran CH4
CH4 + 2O2 → CO2 + 2H2O ∆H = -802 kJ/mol
Struktur ikatannya: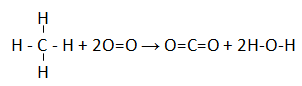
∆H = (∑pemutusan ikatan) – (∑penggabungan ikatan)
∆H = (4xC-H + 2xO=O) – (2xC=O + 4xO-H)
– 802 = ( 4xC-H + 2O=O) – ((1109 + O=O)+(2x(503 + ½ O=O))
– 802 = ( 4xC-H + 2O=O) – ((1109 + O=O)+(1006 + O=O))
– 802 = ( 4xC-H + 2O=O) – (2115 + 2O=O)
-802 = (4xC-H -2115)
4xC-H = -802 + 2115
C-H = 328,25 kJ/mol
Soal No.25
Diketahui ∆Hfo CO2(g) = -394 kJ/mol, ∆Hfo H2O(g) = -285 kJ/mol, dan ∆Hfo C2H5OH(l) = -227 kJ/mol. Tentukan nilai kalor bakar dari alkohol (C2H5OH). (Ar C = 12, H = 1, O = 16)
PEMBAHASAN :
Mr C2H5OH
Reaksi pembakaran C2H5OH
C2H5OH + 3 O2 → 2CO2 + 3H2O
∆Hr = (∆Hfo CO2 x 2 + ∆Hfo H2O x 3) – (∆Hfo C2H5OH x 1 + ∆Hfo O2 x 3)
∆Hr = (-394 x 2 + -285 x 3) – (-227 + 0)
∆Hr = -1643 + 227 = -1416 kJ/mol
Nilai kalor bakar = ∆Hr x Mr = -1416 kJ/mol x 46 = 65.136 kJ/gram
Sumber Soal : Kimia Kelas XI, Pengarang Unggul Sudarmo Penerbit Erlangga
Soal Ulangan Pilihan Ganda (PG) Termokimia
Soal No.26
Persamaan termokimia yang termasuk perubahan entalpi pembentukan adalah…
- 2C(s) +3H2(g) + 1/2 O2 (g) → C2H5OH(l) ΔH = -278 kJ
- Ca2+(aq) + 2NO3—(aq) → Ca(NO3)2(s) ΔH = -1.207 kJ
- NH3(g) + HCl(g) → NH4Cl(g) ΔH = -175,9 kJ
- Na+(aq) + Cl—(aq) → NaCl(aq) ΔH = -788 kJ
- 2SO2(g) + O2(g) → 2SO3(g) ΔH = -196,6 kJ
PEMBAHASAN :
Entalpi pembentukan merupakan entalpi pembentukan 1 mol senyawa (senyawa sebagai produk) dibentuk dari unsur-unsurnya yang stabil.
- Benar, pembentukan C2H5OH dibentuk dari unsur-unsurnya yang stabil
- Salah, karena dibentuk dari ion-ionnya
- Salah, karena dibentuk dari senyawa
- Salah karena dibentuk dari ion-ionnya
- Salah karena dibentuk dari senyawa
Maka jawaban yang paling tepat adalah A
Jawaban A
Soal No.27
Persamaan termokimia yang sesuai dengan pembakaran 2 mol gas SO2 yang membebaskan kalor sebesar 196,6 kJ adalah….
- SO2(g) + 1/2 O2(g) → SO3(g) ΔH = -98,3 kJ
- 2SO2(g) + O2(g) → 2SO3(g) ΔH = -98,3 kJ
- 2SO2(g) +O2(g) → 2SO3(g) ΔH = +196,6 kJ
- S(s) +O2(g) → SO2(g) ΔH = – 196,6 kJ
- S(s) +O2(g) → SO2 (g) ΔH = +98,3 kJ
PEMBAHASAN :
Reaksi pembakaran merupakan reaksi suatu zat dengan O2. Jika diketahui 2 mol gas SO2 yang dibakar artinya koefisien SO2 nya = 2 karena di termokimia mol = koefisien yang membebaskan kalor sebesar 196,6 kJ atau jika ditulis persamaan termokimianya:
2SO2(g) +O2(g) → 2SO2(g) ΔH = -196,6 kJ (tanda (-) karena membebaskan kalor)
Maka jika 1 mol SO2 dibakar atau koefisien SO2 = 1, maka persamaan termokimianya:
SO2(g) + 1/2 O2(g) → SO2(g) ΔH = -98,3 kJ
Jawaban A
Soal No.28
Diketahui persamaan reaksi:
4Fe(s) + 3O2(g) → 2Fe2O3(s) ΔH = -3.500 kJ
Reaksi pembakaran 16,8 gram besi (Ar Fe = 56) menghasilkan energi sebesar….
- 1.113 kJ
- 1.050 kJ
- 525,0 kJ
- 262,5 kJ
- 224,7 kJ
PEMBAHASAN :
Menentukan mol besi yang dibakar dari data yang diketahui![]()
![]()
Dari soal diketahui persamaan termokimia :
4Fe(s) + 3O2(g) → 2Fe2O3(s) ΔH = -3.500 kJ
untuk 4 mol Fe (dilihat dari koefisien) membebaskan kalor sebesar 3.500 kJ, maka untuk 0,3 mol dapat di cari lewat perbandingan:![]()
![]()
Di pilihan tidak ada yang bertanda negatif karena sudah diwakili oleh kata “menghasilkan”
Jawaban D
Soal No.29
100 mL larutan HCl 2 M dengan suhu awal 26 oC ditambahkan 100 mL larutan NaOH 2M. Setelah dicampurkan suhu akhir sebesar 33 oC. Diketahui kalor jenis larutan = 4,2 J/gK maka perubahan entalpi reaksinya adalah….
- -29,4 kJ/mol
- -5,88 kJ/mol
- -11,76 kJ/mol
- +29,40 kJ/mol
- +5,88 kJ/mol
PEMBAHASAN :
Diketahui:
ΔT = (33-26) oC = 7 oC = 7 K (selisih akan selalu sama untuk oC maupun kelvin)
Menentukan massa larutan:
m = (Va + Vb). ρ = (100 + 100)ml. 1 gr/ml = 200 gram
Menentukan kalor reaksi:
qr = -(qsistem + qkalorimeter) = -(m.c.ΔT) (q kalorimeter diabaikan karena tidak diketahui kapasitas jenisnya
qr = – (200 gr. 4,2 J/gK. 7 K) = -5.880 J = -5,88 kJ
Menentukan mol H2O yang diperoleh dari reaksi netralisasi
mol HCl = 100 ml x 2 M = 200 mmol = 0,2 mol
mol NaOH = 100 ml x 2 M = 200 mmol = 0,2 mol
HCl + NaOH → NaCl + H2O
Mula-mula 0,2 0,2 – –
Reaksi 0,2 0,2 – 0,2 0,2 +
Sisa – — 0,2 0,2
maka ΔH reaksinya adalah![]()
Jawaban A
Soal No.30
Jika diketahui persamaan reaksi:
C(s) + O2(g) → CO2(g) ΔH = -394 kJ
H2(g) + 1/2 O2(g) → H2O(g) ΔH = -242 kJ
3C(s) + 4H2(g) → C3H8(g) ΔH = -104 kJ
Maka perubahan entalpi untuk reaksi:
C3H8(g) + 5O2(g) → 3CO2(g) + 4H2O(g) adalah….
- -111 kJ
- -230 kJ
- -711 kJ
- -1.182 kJ
- -2.046 kJ
PEMBAHASAN :
Soal ini bisa dikerjakan menggunakan hukum Hess atau data ΔHof.
Jika menggunakan hukum Hess, maka reaksi yang diketahui ΔH nya dirubah agar sama jumlah dan posisinya dengan zat-zat di reaksi yang ditanyakan. Maka perubahannya :
Reaksi I (dikali 3) : 3C + 3O2 → 3CO2 ΔH = – 1182 kJ
Reaksi II (dikali 4) : 4H2 + 2O2 → 4H2O ΔH = – 968 kJ
Reaksi III (dibalik) : C3H8 → 3C + 4H2 ΔH = +104 kJ +
C3H8 + 5O2 → 3CO2 + 4H2O ΔH = – 2046 kJ
Jawaban E
Soal No.31
Diketahui diagram tahap reaksi pembentukan gas SO3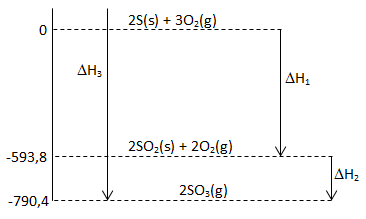
Berdasarkan diagram di atas, nilai ΔH2 adalah….
- +790,4 kJ
- +593,8 kJ
- +196,6 kJ
- -196,6 kJ
- -593,8 kJ
PEMBAHASAN :
Menentukan ΔH2 bisa dihitung dari selisih nilai akhir – awal. Bisa dilihat dari gambar berikut:
maka ΔH2 = H akhir – H awal = -790,4 – (-593,8) = -196,6 kJ
Jawaban D
Soal No.32
Diketahui beberapa entalpi pembentukan standar (ΔHf) untuk KClO3, KCl dan SO2 berturut-turut -391,2 kJ/mol, -435,9 kJ dan -296,9 kJ. Perubahan entalpi reaksi:
2KClO3(s) + 3S(g) → 2KCl(s) + 3SO2(g)
- +435,6 kJ
- +341,6 kJ
- -341,6 kJ
- +980 kJ
- -980 kJ
PEMBAHASAN :
Menentukan ΔHr dari data ΔHof menggunakan rumusan:
ΔHr = (Σ ΔHof produk x koefisien) – (Σ ΔHof produk x koefisien)
ΔHr = (ΔHof KCl x 2 + ΔHof SO2 x3) – (ΔHof KClO3 x 2 + ΔHof S x 3)
ΔHr = (-435,9 x 2 + (-296,9 x 3)) – (-391,2 x 2 + 0 x 3) = (-1762,5 + 782,4) = -980 kJ
Jawaban E
Soal No.33
Data entalpi pembentukan standar beberapa senyawa
ΔHof C4H10 = -125 kJ/mol
ΔHof CO2 = -393 kJ/mol
ΔHof H2O = -242 kJ/mol
Perubahan entalpi untuk reaksi:
C4H10(g) + 13/2 O2(g) → 4CO2(g) + 5H2O(g)
adalah….
- -2.907 kJ
- -2.657 kJ
- -2.560 kJ
- -760 kJ
- -510 kJ
PEMBAHASAN :
Menentukan ΔHr dari data ΔHof menggunakan rumusan:
ΔHr = (Σ ΔHof produk x koefisien) – (Σ ΔHof produk x koefisien)
ΔHr = (ΔHof CO2 x 4 + ΔHof H2O x5) – (ΔHof C4H10 x 1 + ΔHof O2 x 13/2)
ΔHr = (-393 x 4 + -242 x 5) – (-125 x 1 + 0x13/2) = (-1572 + (-1210)) + 125 = -2.657 kJ
Jawaban B
Soal No.34
Diketahui perubahan entalpi dari reaksi berikut:
2NH3(g) → N2(g) + 3H2(g) ΔH = +97 kJ
Energi ikatan rata-rata N≡N = 941 kJ, H-H = 436 kJ. Energi ikatan rata-rata untuk N-H adalah….
- 782 kJ
- 717 kJ
- 391 kJ
- 359 kJ
- 319 kJ
PEMBAHASAN :
Menentukan ΔHr dari data energi ikatan menggunakan rumusan:
ΔHr = Energi ikatan pereaksi – Energi ikatan produk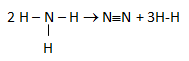
+97 = (6 x N-H) – (N≡N + 3 x H-H) = (6 x N-H) – (941 + 3 x 436) = (6 x N-H) – (2249)
6 x N-H = +97 + 2249 = 2346
N-H = 2346/6 = +391 kJ
Jawaban C
Soal No.35
Data energi ikatan rata-rata sebagai berikut:
C-H = 99 kkal
C=C = 164 kkal
C-Cl = 79 kkal
C-C = 83 kkal
H-Cl = 103 kkal
Besarnya perubahan entalpi dari reaksi berikut adalah….
C2H4 + HCl → C2H5Cl
- -8 kkal
- -6 kkal
- +6 kkal
- +8 kkal
- +36 kkal
PEMBAHASAN :
Untuk menjawab soal tersebut reaksi dibuat rumus strukturnya masing-masing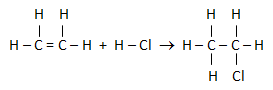
Jika ikatan di kiri dan di kanan sama bisa di coret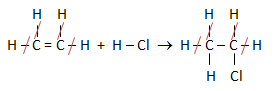
Menentukan ΔHr dari data energi ikatan menggunakan rumusan:
ΔHr = Energi ikatan pereaksi – Energi ikatan produk
ΔHr = (C = C + H-Cl) – (C-C + C-H + C-Cl) = (164 + 103) – (83 + 99 + 79)
ΔHr = (267 – 261) = + 6 kkal
Jawaban C
Soal Termokimia Pilihan Ganda (PG) SBMPTN
Soal No.36 (SBMPTN 2018)
Gas metanol dapat terbentuk melalui reaksi reduksi gas formaldehis (HCHO) oleh gas hidrogen menurut reaksi berikut
HCHO(g) + H2(g) → CH3OH(g)
Jika diketahui entalpi reaksi reduksi tersebut adalah 9 kJ mol-1 dan energi ikatan rata-rata C-H, C=O, O-H, dan H-H berturut-turut adalah 416, 799, 463 dan 432 kJ mol-1, nilai energi ikatan rata-rata C-O adalah…
- 143 kJ mol-1
- 243 kJ mol-1
- 253 kJ mol-1
- 343 kJ mol-1
- 361 kJ mol-1
PEMBAHASAN :
Menentukan perubahan entalpi menggunakan data energi ikatan dapat menggunakan rumusan:
ΔHr = (Energi ikatan pemutusan) – (Energi ikatan pembentukan) = (Ei Kiri) – (Ei Kanan)
Untuk menetukan perubahan entalpinya kita terlebih dahulu membuat rumus struktur zat yang terlibat dalam reaksi: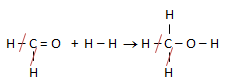
Jika ada ikatan yang sama di kiri dan di kanan maka dapat di coret. Dari reaksi tersebut di dapat:
ΔHr = (C=O + H-H) – (C-H + C-O + O-H)
9 kJ/mol = (799 + 432) – (416 + C-O + 463)
9 = (1231) – (879 + C-O)
879 + C-O = 1222
C-O = 1222 – 879 = 343 kJ/mol
Jawaban D
Soal No.37 (SBMPTN 2017)
Kalor pembakaran propana (Mr = 44) adalah 500 J.mol-1. Apabila seluruh kalor yang dihasilkan dari pembakaran 88 g propana digunakan untuk memanaskan 100 g metanol, temperatur metanol naik dari 25 oC menjadi 29 oC. Kalor jenis metanol dalam J.g-1.oC-1 adalah….
- 0,5
- 1,0
- 1,5
- 2,0
- 2,5
PEMBAHASAN :
Menentukan mol propana![]()
pembakaran untuk 2 mol propana adalah = 2 mol x 500 J/mol = 1.000 J
Menentukan kalor jenis metanol
q reaksi = m. c. ΔT
1000 J = 100 gr . c . (29-25) oC![]()
Jawaban E
Soal No.38 (SBMPTN 2016)
Energi ikatan rata-rata C-N, O-H, dan C=O berturut-turut adalah 305, 467, dan 745 kJ mol-1.
CO2(g) + 2NH3(g) → (NH2)2CO(g) + H2O(g) ΔH = -17 kJ mol-1
Energi ikatan rata-rata N-H dalam kJ mol-1 adalah….
- 391
- 782
- 945
- 1527
- 2346
PEMBAHASAN :
Kita buat rumus struktur dari reaksinya:![]()
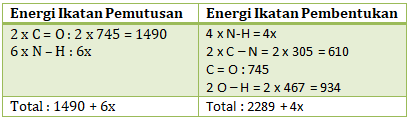
ΔH reaksi = Energi ikatan pemutusan – Energi ikatan pembentukan
-17 kJ/mol = (1490+6x) – (2289 + 4x)
-17 = -799 + 2x
2x = -17 + 799
2x = 782
x = N – H = 391
Jawaban A
Soal No.39 (SBMPTN 2015)
Pembakaran ZnS(s) terjadi menurut reaksi
2ZnS(s) + 3O2(g) → 2ZnO(s) + 2SO2(g)
Jika entalpi pembentukan standar (ΔHof) untuk ZnS(s), ZnO(s), dan SO2(g) berturut-turut adalah -202,9 kJ/mol, -348,0 kJ/mol, dan -296,4 kJ/mol, maka entalpi pembakaran 9,7 g ZnS(s) (Mr = 97) adalah….
- -88,3 kJ
- +88,3 kJ
- -84,7 kJ
- +84,7 kJ
- -44,2 kJ
PEMBAHASAN :
Diketahui:
ΔHof ZnS = -202,9 kJ/mol
ΔHof ZnO = -348,0 kJ/mol
ΔHof SO2 = -296,4 kJ/mol
Menentukan ΔH reaksi dari ΔHof
2ZnS(s) + 3O2(g) → 2ZnO(s) + 2SO2(g)
ΔH reaksi = (∑ΔHof produk x koefisien) – (∑ΔHof pereaksi x koefisien)
ΔH reaksi = (ΔHof ZnO x 2 + ΔHof SO2 x 2) – (ΔHof ZnS x 2 + ΔHof O2 x 3)
ΔH reaksi = (-348,0 x 2 + (-296,4) x 2) – ((-202,9) x 2 + 0 x 3) (ΔHof O2 = 0 karena unsur bebas)
ΔH reaksi = -696 – 592,8 + 405,8 = -883 kJ
ΔH tersebut untuk 2 mol ZnS (Koefisien ZnS = 2)
Menentukan ΔH untuk 9,7 gram ZnS![]()
maka ΔH untuk 0,1 mol adalah![]()
Jawaban E
Soal No.40 (SBMPTN 2014)
Diberikan data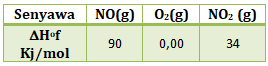
Perubahan entalpi pembakaran 45 g gas NO (Mr = 30) sesuai reaksi 2NO(g) + O2(g) → 2NO2(g) adalah….
- -56 kJ
- -84 kJ
- -112 kJ
- +56 kJ
- +112 kJ
PEMBAHASAN :
Diketahui:
ΔHof NO = 90 kJ/mol
ΔHof O2 = 0,00 kJ/mol
ΔHof NO2 = 34 kJ/mol
Menentukan ΔH reaksi dari ΔHof
2NO(g) + O2(g) → 2NO2(g)
ΔH reaksi = (∑ΔHof produk x koefisien) – (∑ΔHof pereaksi x koefisien)
ΔH reaksi = (ΔHof NO2 x 2) – (ΔHof NO x 2 + ΔHof O2 x 1)
ΔH reaksi = (34 x 2) – (90 x 2 + 0 x 1) (ΔHof O2 = 0 karena unsur bebas)
ΔH reaksi = 68 – 180 = -112 kJ
ΔH tersebut untuk 2 mol NO (Koefisien NO = 2)
Menentukan ΔH untuk 45 gram NO![]()
maka ΔH untuk 1,5 mol adalah![]()
Jawaban B
Soal No.41 (SBMPTN 2013)
Persamaan termokimia isomerisasi etilen oksida menjadi asetaldehid adalah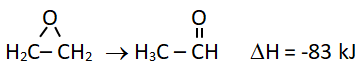
Jika energi ikatan C – O pada etilen oksida adalah 358 kJ/mol, maka energi ikatan C=O pada asetaldehid adalah…
- 83 kJ/mol
- 348 kJ/mol
- 441 kJ/mol
- 799 kJ/mol
- 614 kJ/mol
PEMBAHASAN :
Kita buat rumus struktur dari reaksinya:
ΔH reaksi = Energi ikatan pemutusan – Energi ikatan pembentukan
-83 kJ/mol = 716 – x
x = 716 + 83 = 799 kJ/mol
Jawaban D
Soal No.42 (SBMPTN 2012)
Tabel berikut menyajikan data entalpi pembakaran untuk lima jenis bahan bakar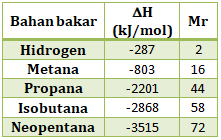
Pembakaran 1 g bahan bakar yang menghasilkan energi paling besar adalah….
- hidrogen
- metana
- propana
- isobutana
- neopentana
PEMBAHASAN :
Besar energi yang dihasilkan untuk 1 gram bahan bakar:
Maka bahan bakar yang menghasilkan energi paling besar adalah gas hidrogen yang akan melepaskan energi sebesar 143,5 kJ (tanda (-) bukan artinya lebih kecil tapi artinya melepaskan)
Jawaban A
Soal No.43 (SNMPTN 2011)
Kalor yang dihasilkan dari pelarutan CaCl2 (Mr = 111) di dalam air digunakan pada kantong penghangat P3K. Reaksi pelarutannya adalah
CaCl2(s) → Ca2+(aq) + 2Cl—(aq) ΔH = -83,6 kJ
Sebuah kantong penghangat dirancang agar suhunya naik dari 25oC menjadi 35oC ketika digunakan. Jika kapasitas kalor kantong penghangat beserta isinya adalah 418 J/oC, massa CaCl2 yang harus ditambahkan ke dalam kantong tersebut adalah….
- 1,11 g
- 5,55 g
- 11,1 g
- 55,5 g
- 222 g
PEMBAHASAN :
Menentukan kalor reaksi (qr)
qr = C. ΔT
qr = 418 J/oC. (35 – 25) oC = 4180 J = 4,180 kJ![]()
![]()
Menentukan massa CaCl2
Gr = n x Mr = 0,05 x 111 = 5,55 gram
Jawaban B
Soal No.44 (SNMPTN 2011)
Diketahui energi ikatan rata-rata sebagai berikut:
C – H = 414 kJ/mol H – Cl = 432 kJ/mol
Cl – Cl = 244 kJ/mol C – Cl = 326 kJ/mol
Perubahan entalpi untuk reaksi berikut:
CH4(g) + Cl2(g) → CH3Cl (g) + HCl(g)
adalah….
- -100 kJ/mol
- +100 kJ/mol
- +728 kJ/mol
- -1342 kJ/mol
- +1342 kJ/mol
PEMBAHASAN :
Kita buat rumus struktur dari reaksinya: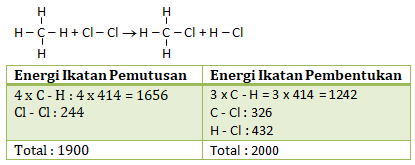
ΔH reaksi = Energi ikatan pemutusan – Energi ikatan pembentukan
ΔH reaksi = 1900 – 2000 = -100 kJ/mol
Jawaban A
Soal No.45 (SNMPTN 2010)
Reaksi pembentukan H2O dari unsur-unsurnya berlangsung sebagai berikut:
O2(g) + 2H2(g) → 2H2O(g)
Energi pembentukan O(g), H(g) masing-masing adalah 248 kJ/mol, dan 227 kJ/mol, sedangkan energi ikat O-H adalah 464 kJ/mol. Pernyataan yang benar untuk reaksi tersebut adalah….
- perubahan entalpi reaksi adalah -452 kJ
- perubahan entalpi pembentukan O2 adalah 248 kJ
- perubahan entalpi pembentukan standar H2O(g) adalah -226 kJ
- perubahan entalpi pembentukan H2(g) adalah 870 kJ
PEMBAHASAN :
- Kita buat rumus struktur dari reaksinya:
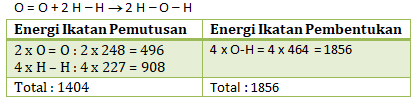
ΔH reaksi = Energi ikatan pemutusan – Energi ikatan pembentukan
ΔH reaksi = 1404 – 1856 = -452 kJ/mol
BENAR - Perubahan entalpi pembentukan O2 = 2 x -248 kJ = -496 kJ
SALAH - perubahan entalpi pada no 1 adalah untuk 2 mol, maka perubahan entalpi pembentukan standar H2O(g) (untuk 1 mol) adalah
-452/2 = -226 kJ
BENAR - Entalpi pembentukan H2 = 2 x -227 = -454 kJ
SALAH
Jawaban B
Ayo berlatih. Uji kemampuanmu. Klik link di bawah yah:
Latihan Soal
Semoga Bermanfaat