Untuk Pembelajaran selanjutnya…
Halo anak SMA baru. Selamat yah sekarang kamu ada di kelas X. Materi kimia setelah pengenalan ilmu kimia adalah struktur atom dan sistem periodik unsur (SPU). Daripada baca sebuku tebel, kita kasih kamu ringkasan materinya disini. Selain itu, biar tambah mateng kita kasih gratis video pembelajarannya dan ada 47 contoh soal yang bikin kamu molotok di bab ini. Terakhir coba latihannya juga! Ayo mulai rayapi di daftar isinya yah..
Pengertian Atom
Atom Merupakan partikel terkecil yang sudah tidak dapat dibagi-bagi lagi dengan cara biasa
Partikel Penyusun Atom
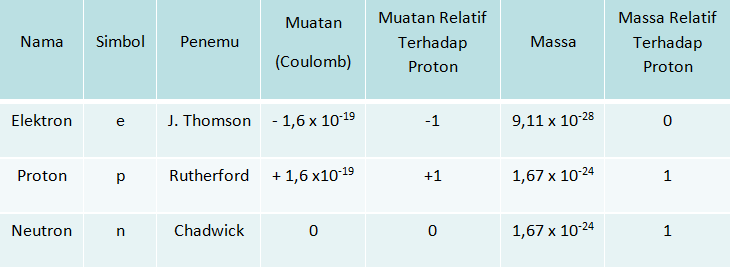
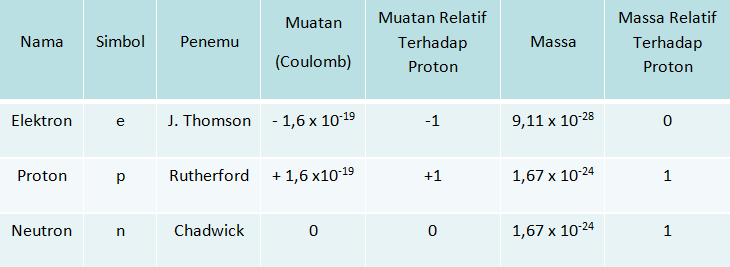
Partikel penyusun inti atom adalah proton dan neutron sedangkan elektron mengelilingi inti atom.
Nomor Atom dan Massa Atom
Nomor atom (Z) menunjukkan jumlah proton dalam atom.
- Untuk atom netral(tidak bermuatan) jumlah proton (p) = jumlah elektron (e)
- Untuk ion negatif (anion) jumlah proton (p) < jumlah elektron (e)
- Untuk ion positif (kation) jumlah proton (p) > jumlah elektron (e),
Massa atom (A) menunjukkan jumlah dari proton (p) dan neutron (n).
A = p + n
Notasi Atom
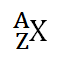
X = Unsur/atom
A = Massa Atom/Nomor Massa = p + n
n = A – p
Z = Nomor Atom = p = e (atom netral)
Contoh Soal
Tentukan nilai A, Z, p, e, n untuk atom berikut :
Jawaban:
- A =23, Z = 11, p = 11, e = 11, n =23-11 = 12
- A =19, Z = 9, p = 9, e = 9, n = 19 – 9 = 10
Notasi Ion
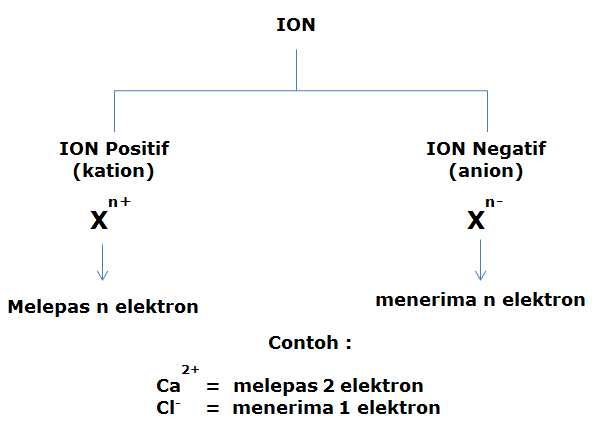
Contoh Soal:
Tentukan nilai A, Z, p, e, n untuk ion berikut :
Jawaban:
- A =23, Z = 11, p =11, e = 11-1 = 10, n = 23 – 11 = 12 (melepas 1 elektron)
- A =16, Z = 8, p =8, e = 8+2 = 10, n = 16 – 8 = 8 (menerima 2 elekron)
Perkembangan Model Atom
Model Atom Dalton
Atom merupakan partikel terkecil suatu materi yang berbentuk bola pejal.
- Atom suatu unsur memiliki sifat yang sama, berbeda dengan unsur yang lain
- Atom dapat bergabung dengan atom lain membentuk suatu molekul dengan perbandingan sederhana.
Model Atom Thomson
Atom merupakan bola yang bermuatan positif dan di dalamnya tersebar elektron yang bermuatan negatif.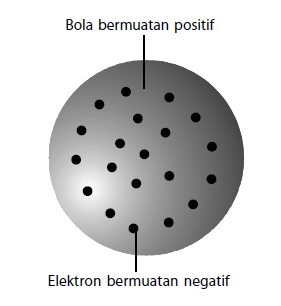
- Model ini timbul karena ditemukannya elektron dalam atom.
- Model ini disebut juga teori Roti Kismis, karena mirip dengan roti kismis.
Model Atom Rutherford
Atom terdiri atas inti yang bermuatan positif dan dikelilingi oleh elektron.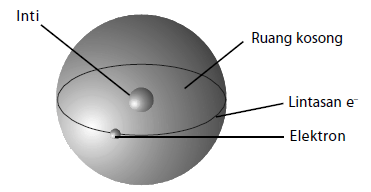
- Model ini lahir karena Rutherford menemukan adanya inti atom melalui percobaannya.
- Kelemahannya yaitu ketidakmampuan menjelaskan mengapa elektron tidak jatuh ke inti akibat gaya tarik elektrostatik
Model Atom Niels Bohr
Atom terdiri atas inti yang terdiri atas proton dan neutron dan dikelilingi oleh elektron pada lintasan dengan tingkat energi yang tetap.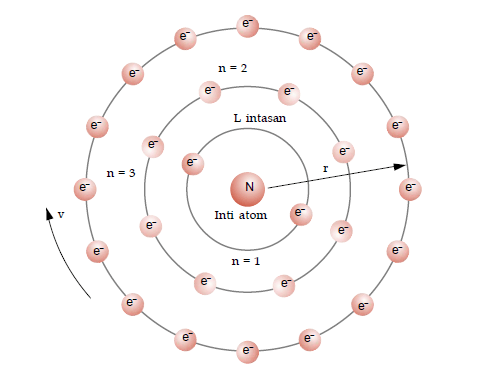
- Elektron dapat berpindah ke tingkat energi yang lebih tinggi (kulit yang lebih besar) dengan menyerap energi.
- Elektron dapat berpindah ke tingkat energi yang lebih rendah (kulit yang lebih kecil) dengan melepas energi.
Kelemahan Teori Atom Bohr
Teori Atom Bohr memiliki beberapa kelemahan, diantaranya:
- Hanya menjelaskan Spektrum atom Hidrogen
- Tidak dapat menjelaskan spektrum atom Hidrogen memiliki garis-garis tambahan (Efek Zeeman dan Efek Strack).
Teori Dasar Munculnya Teori Atom Modern
Dualisme de Broglie:
“Elektron dapat bertindak sebagai partikel juga sebagai gelombang”.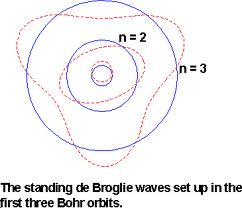
Prinsip Ketidakpastian Heisenberg:
“Elektron tidak ditemukan secara pasti di dalam lintasan tetapi hanya kebolehjadian”.
Daerah Kebolehjadian ditemukannya elektron disebut Orbital
Persamaan Schrödinger
“Schrödinger membuat persamaan gelombang yang didasari pernyataan de broglie”.persamaannya:![]()
Persamaan ini memperkirakan daerah kebolehjadian ditemukannya elektron (Orbital).
Bilangan Kuantum
- Bilangan kuantum merupakan gambaran kedudukan elektron dalam suatu atom dan membedakannya dengan elektron lainnya.
- Bilangan kuantum diperoleh dari penurunan persamaan Schrödinger.
- Bilangan kuantum memiliki 4 jenis, diantaranya bilangan kuantum utama (n), Bilangan kuantum azimut (l ), Bilangan kuantum magnetik (m) dan Bilangan kuantum spin (s)
Bilangan kuantum utama (n)
menunjukkan kulit yang ditempati elektron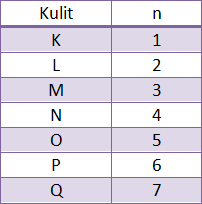
Bilangan kuantum azimut (l )
Menunjukan sub kulit yang ditempati elektron
Hubungan kulit (n) dengan subkulit (l):
lmaks = (n-1)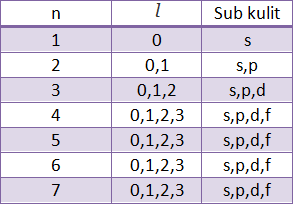
Bilangan kuantum magnetik (m)
Menunjukan orientasi elektron dalam orbital
Hubungan azimuth (l) dengan magnetik (m):
m = – l, 0, +l
Hubungan ini juga dapat menentukan jumlah orbital masing-masing sub kulit, satu orbital akan diisi maksimal oleh 2 elektron.
Bilangan kuantum spin (s)
Menunjukan arah rotasi elektron
satu orbital diisi oleh maksimal dua elektron, satu mengarah ke atas (s = + ½ ), satu lagi mengarah ke bawah (s= – ½)
Penulisan bilangan kuantum dalam konfigurasi elektron
Contoh soal
- Tentukan harga n dan l elektron yang terletak pada orbital :
- 4s
- 3d
- Tuliskan ke 4 bilangan kuantum yang mungkin pada orbital :
- 4p
- 3d
- 4f
Jawaban
-
- n = 4 (kulit ke-4), dan l = 0 (subkulit s)
- n = 3 (kulit ke-3), dan l = 2 (subkulit d)
- n = 4, l = 1, m = -1, 0, +1 , s = +½, -½
- n = 3, l = 2, m = -2,-1, 0, +1,+2 , s = +½, -½
- n = 4, l = 3, m = -3,-2,-1, 0, +1,+2,+3 , s = +½, -½
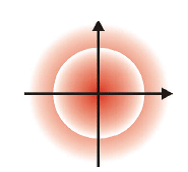
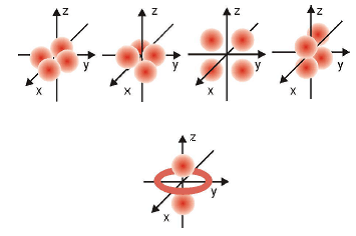
Bentuk Orbital
Orbital s
Orbital p
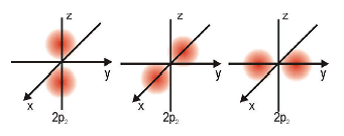
Orbital d
Konfigurasi Elektron
Tiga Aturan konfigurasi atom modern :
Aturan Aufbau (Membangun)
“Pengisian elektron dimulai dari orbital yang tingkat energinya lebih rendah kemudian ke tingkat energi yang lebih tinggi”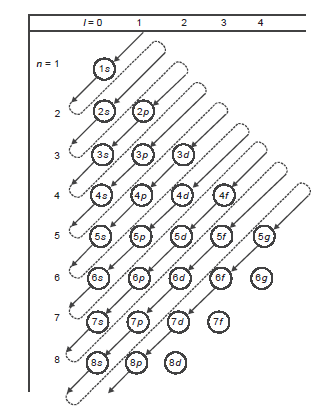
Urutan subkulit dari energi terendah sampai tertinggi yaitu sebagai berikut:
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, …dst
Cara cepat menghapal:
Contoh soal konfigurasi elektron:
Tuliskan konfigurasi elektron atom berikut dengan lengkap:
12Mg : 1s2 2s2 2p6 3s2
20Ca : 1s2 2s2 2p6 3s2 3p6 4s2
30Zn : 1s2 2s2 2p6 3s2 3p6 4s2 3d10
23V : 1s2 2s2 2p6 3s2 3p6 4s2 3d3
14Si : 1s2 2s2 2p6 3s2 3p2
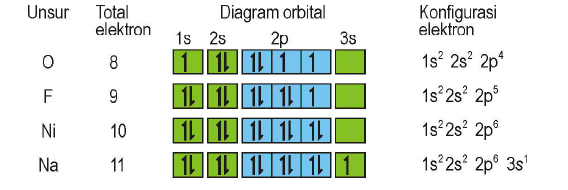
Aturan Hund
“Pengisian elektron pada orbital yang setingkat energinya mula-mula elektron diisi dengan tidak berpasangan terlebih dahulu sesudah diisikan baru kemudian berpasangan”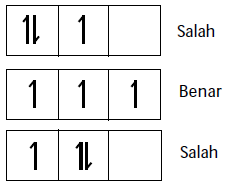
Contoh soal:
Larangan Pauli
Elektron yang menghuni orbital tidak boleh memiliki ke 4 bilangan kuantum yang sama. n, l, m boleh sama tetapi bilangan kuantum s akan berbeda.
Contoh Soal
Tentukan ke 4 bilangan kuantum elektron terakhir dari unsur berikut:
8O : 1s2 2s2 2p4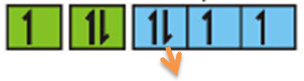
Elektron yang terakhir di tulis
Bilangan kuantumnya:
n = 2, l = 1, m = -1, s = -1/2
Cara Menulis Konfigurasi Singkat
Konfigurasi elektron bisa disingkat menggunakan konfigurasi elektron gas mulia
Konfigurasi gas mulia
2He : 1s2
10Ne : 1s2 2s2 2p6
18Ar : 1s2 2s2 2p6 3s2 3p6
36Kr : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
54Xe : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 …….dst
86Rn : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 …….dst
Menentukan dengan lebih cepat:
Caranya:
- Tentukan gas mulia yang dijadikan penyingkat, nomor atom gas mulia harus lebih kecil dari nomor atom yang ditentukan
- Lanjutkan konfigurasi elektron dari gas mulia, caranya:
Sesudah : [He] 2s2
[Ne] 3s2
[Ar] 4s2
[Kr] 5s2
[Xe] 6s2
[Rn] 7s2
Contoh:
Tentukan konfigurasi elektron dengan singkat
- 22Ti
- 17 Cl
- 53 I
- 22Ti, nomor atomnya 22 dibawahnya ada [18Ar], tersisa tinggal 4 elektron lagi sehingga menjadi
22Ti : [Ar] 4s2 3d2 - 17Cl, nomor atomnya 17 dibawahnya ada [10Ne], tersisa tinggal 7 elektron lagi sehingga menjadi
17Cl : [Ne] 3s2 3p5 - 53I, nomor atomnya 53 dibawahnya ada [36Kr], tersisa tinggal 17 elektron lagi sehingga menjadi
53I : [Kr] 5s2 4d10 5p5
Kestabilan subkulit d terisi penuh dan setengah penuh
Sesuai aturan Aufbau Konfigurasi Cr (24) dan Cu (29) adalah :
24Cr : [Ar] 4s2 3d4
29Cr : [Ar] 4s2 3d9
Kenyataannya ini kurang stabil, yang betul adalah:
24Cr : [Ar] 4s1 3d5
29Cr : [Ar] 4s1 3d10
Hal ini disebabkan karena kondisi 3d4 kurang stabil dibandingkan 3d5, begitu pula 3d9 kurang stabil dibanding 3d10
Menentukan Golongan dan Periode
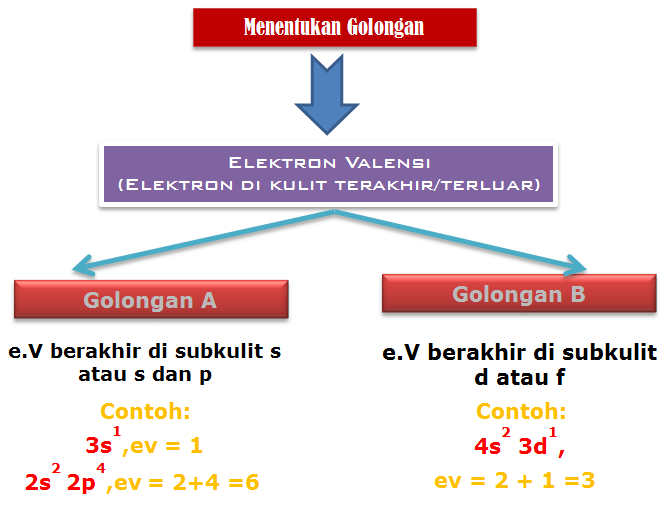
Penentuan Golongan A (Utama)
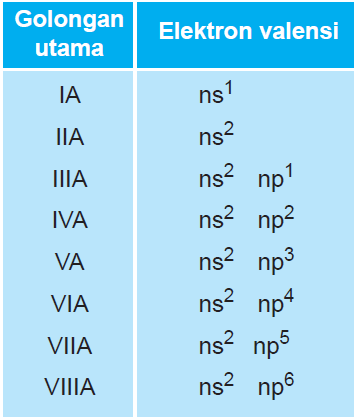
Jumlah elektron valensi merupakan golongan unsur tersebut
Contoh :
- 11Na : 1s2 2s2 2p6 3s1,ev= 1 Golongan = IA
- 8O : 1s2 2s2 2p4,ev = 2+4 =6 Golongan = VI A
Penentuan Periode
Periode ditentukan dari kulit terluar
Contoh:
- 11Na : 1s2 2s2 2p6 3s1, kulit terluar =3 Periode = 3
- 8O : 1s2 2s2 2p4, kulit terluar =2 Periode = 2
Penentuan Golongan B (Transisi)
Jumlah elektron di sub kulit s terakhir dan d merupakan golongan unsur tersebut

Contoh:
- 21Sc : [Ar] 4s2 3d1,ev= 2 + 1 = 3 Golongan = III B
- 30Zn : [Ar] 4s2 3d10,ev= 2 + 10 = 12 Golongan = I B
Penentuan Periode
- 21Fe : [Ar] 4s2 3d1,kulit terakhir = 4 Periode = 4
- 48Cd : [K4] 5s2 4d10,kulit terakhir = 5 Periode = 5
- Struktur Atom 1
- Struktur Atom 2
- SPU
Soal Essay Struktur Atom & SPU
Soal No.1
Sebutkan kelemahan teori atom Rutherford sehingga membawa Niels Bohr menyelidiki spektrum atom hidrogen.
PEMBAHASAN :
Jika elektron bergerak mengelilingi inti akan memancarkan energi yang mengakibatkan laju elektron semakin lambat dan akhirnya dapat tertarik ke inti atom
Soal No.2<
Asumsi-asumsi apa saja yang dikemukakan Niels Bohr dalam menyusun teori atomnya? Atas dasar apa Niels Bohr menyusun teori atom tersebut?
PEMBAHASAN :
Niels bohr berasumsi bahwa model kedudukan elektron dan inti atom menyerupai sistem tata surya dengan inti atom yang berisi proton dan neutron sebagai pusatnya dan elektron-elektron mengelilingi inti atom pada lintasan-lintasan atau orbit tertentu. Niels Bohr menyusun teori tersebut atas dasar adanya spektrum kontinyu dan spektrum garis yang terjadi akibat adanya perpindahan elektron.
Soal No.3
Apa kelemahan teori atom Bohr? Jelaskan.
PEMBAHASAN :
Niels bohr gagal menjelaskan terjadinya spektrum dari atom yang berelektron banyak
Soal No.4
Elektron mempunyai dualisme sifat sebagai partikel dan gelombang. Apa maksudnya dualisme sifat tersebut?
PEMBAHASAN :
Elektron memiliki sifat sebagai partikel dan gelombang. Adanya teori dualisme partikel gelombang bahwa lintasan elektron tidak lagi merupakan suatu garis melingkar seperti yang digambarkan Niels Bohr. Lintasan elektron digambarkan mengikuti pola gelombang stasioner (diam).
Soal No.5
Bukti apakah yang menunjukkan bahwa elektron mempunyai sifat gelombang?
PEMBAHASAN :
Bukti percobaan pola difraksi dari elektron sebab gejala difraksi hanya dapat dijelaskan dengan menganggap elektron sebagai gelombang.
Soal No.6
Sebutkan jenis bilangan kuantum dan mencirikan apakah bilangan-bilangan kuantum tersebut?
PEMBAHASAN :
- Bilangan kuantum utama (n),menentukan besarnya tingkat energi suatu elektron yang mencirikan ukuran orbital
- Bilangan kuantum azimuth (l), menentukan bentuk orbital dan besarnya momentum sudut elektron
- Bilangan kuantum magnetik (m), menentukan arah orientasi dari orbital di dalam ruang relatif terhadap orbital yang lain
- Bilangan kuantum spin (s), menunjukan arah putar elektron dalam orbital
Soal No.7
Tentukan harga bilangan kuantum n, l, m, dan s yang mungkin dari elektron yang menempati subkulit 3p.
PEMBAHASAN :
n = 3
l = 1
m = -1,0,+1
s = + ½ , – ½
Soal No.8
Berapa jumlah elektron maksimum yang dapat menempati subkulit yang ditandai dengan harga n = 3, dan l = 2?
PEMBAHASAN :
n = 3 dan l = 2 berarti 3d, dimana setiap sub kulit d maksimal diisi oleh 10 elektron, maka jumlah elektron maksimumnya yaitu 10 elektron
Soal No.9
Diketahui elektron A mempunyai bilangan kuantum n = 3, l = 1 dan m = -1 dan elektron B mempunyai bilangan kuantum n = 2, l = 1, m = -1
- Apakah elektron tersebut menempati orbital yang sama? Jelaskan
- Elektron manakah yang mempunyai bilangan kuantum n=2, l = 1 dan m = -1
PEMBAHASAN :
Soal No.10
Buatlah konfigurasi elektron dari atom-atom berikut, kemudian tentukan berapa orbital yang terisi elektron dan berapa elektron yang tidak berpasangan
- 27Co
- 19K
- 44Ru
- 56Ba
- 34Se
PEMBAHASAN :
Soal No.11
Tentukan konfigurasi elektron dari ion V3+ jika nomor atom V = 23 Buatlah diagram orbital untuk V3+ tersebut.
PEMBAHASAN :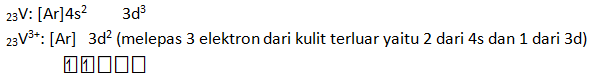
Soal No.12
Diketahui atom besi mempunyai nomor atom 26.
- Tuliskan konfigurasi elektron atom besi
- Ada berapa orbital yang terisi elektron?
- Ada berapa orbital yang terisi elektron tidak berpasangan?
- Bagaimana konfigurasi elektron dari ion Fe3+?
PEMBAHASAN :
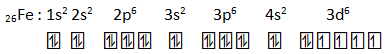
- Orbital terisi elektron : 15
- elektron yang tidak berpasangan : 4
- 26Fe3+ : 1s2 2s2 2p6 3s2 3p6 3d5 (melepas 3 elektron dari kulit terluar yaitu 2 dari 4s dan 1 dari 3d)
Soal No.13
Atom A dan B mempunyai konfigurasi elektron sebagai berikut:
A: 1s2 2s2 2p6 3s2 3p5
B: 1s2 2s2 2p6 3s2 3p6
Manakah di antara kedua atom tersebut yang lebih stabil? Jelaskan.
PEMBAHASAN :
Soal No.14
Suatu atom mempunyai konfigurasi elektron : 1s2 2s2 2p64s1. Mungkinkah konfigurasi elektron tersebut dapat terjadi? Berikan alasan Anda.
PEMBAHASAN :
Tidak mungkin terjadi karena menurut aturan aufbau pengisian elektron dimulai dari orbital dengan tingkat energi terendah ke orbital tertinggi. Sesudah 2p seharusnya dilanjutkan ke 3s bukan ke 4s
Soal No.15
Mengapa jumlah subkulit yang menyusun kulit M hanya terdiri dari 3 subkulit? Jelaskan.
PEMBAHASAN :
Hubungan sub kulit dengan kulit yaitu:
lmaks = (n-1)
jika n =3 berarti lmaks = 3-1 = 2
maka sub kulitnya : 0, 1, 2 atau hanya ada 3 sub kulit
Soal No.16
Dengan tanpa melihat sistem periodik unsur, tentukan letak unsur-unsur berikut,
- 26A
- 37B
- 53C
- 48D
PEMBAHASAN :
- 26Fe : 1s2 2s2 2p6 3s2 3p6 4s2 3d6,
e.v = 8 berakhir di sub kulit d maka Gol VIIIB
Jumlah kulit 4 periode 4 - 37B : [Kr] 5s1,
e.v = 1 berakhir di sub kulit s maka Gol IA
Jumlah kulit 5 periode 5 - 53C : [Kr] 5s2 4d10 5p5
e.v = 7 berakhir di sub kulit p maka Gol VII A
Jumlah kulit 5 periode 5 - 48D : [Kr] 5s2 4d10
e.v = 12 berakhir di sub kulit d maka Gol IIB
Jumlah kulit 5 periode 5
Soal No.17
Suatu unsur di dalam sistem periodik terdapat pada golongan VIA periode keempat, tentukanlah konfigurasi elektron unsur tersebut.
PEMBAHASAN :
Golongan VI A berarti elektron valensinya = 6 berakhir di sub kulit p, periode keempat berarti jumlah kulitnya = 4, maka konfigurasi elektronnya: [Ar] 4s2 3d10 4p4
Soal No.18
Apa yang dimaksud dengan unsur-unsur blok d?
PEMBAHASAN :
Unsur yang pengisian elektronnya berakhir di sub kulit d
Soal No.19
Diketahui unsur-unsur dengan konfigurasi elektronnya sebagai berikut:
A : 1s2 2s2 2p6
B: [Ne] 3s2
C: [Ne]3s23p5
D: [Ar] 4s23d104p1
E: [Ar] 4s1
Di antara unsur-unsur tersebut, tentukanlah:
- Unsur-unsur yang terletak dalam satu periode
- Unsur-unsur yang terletak dalam satu golongan
- Unsur yang mempunyai jari-jari atom terbesar
- Unsur yang mempunyai afinitas elektron terbesar
- Urutkanlah harga energi ionisasi unsur-unsur tersebut dari yang paling kecil ke yang paling besar.
PEMBAHASAN :
- Unsur yang satu periode = jumlah kulit sama = unsur B & C kemudian unsur D & E
- Unsur yang satu gelombang = elektron valensi sama = tidak ada unsur yang satu golongan
- Unsur E karena terletak paling kiri dan terbawah
- Unsur C karena yang paling mudah menangkap elektron
- E – B – D – C – A karena dari kiri ke kanan energi ionisasi makin besar dari atas ke bawah makin kecil
Soal No.20
Suatu unsur di dalam sistem periodik terletak pada golongan VB periode keempat.
- Buatlah konfigurasi elektronnya
- Berapa elektron yang tidak berpasangan?
- Bila unsur tersebut membentuk ion yang bermuatan +3, bagaimanakah konfigurasi elektron ionnya?
PEMBAHASAN :
- Golongan VB berarti elektron valensinya = 5 berakhir di subkulit d, periode keempat berarti jumlah kulit = 4, sehingga konfigurasinya:
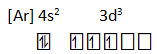
- Elektron yang tidak berpasangan = 3
- X3+ : [Ar] 3d2 (melepas 3 e dari kulit terluar terlebih dahulu, 2 dari 4s dan 1 dari 3d)
Soal No.21
Ion X3+ mempunyai konfigurasi elektron [Ar] 3d5, tentukan letak unsur tersebut dalam sistem periodik unsur.
PEMBAHASAN :
X3+ : [Ar] 3d5 (sudah melepas 3 e)
X : [Ar] 4s2 3d6
Elektron valensi = 8 berakhir di sub kulit d maka golongannya = VIII B
Jumlah kulit = 4, periode = 4
Soal No.22
Suatu unsur terletak pada blok d dan mempunyai 3 elektron tidak berpasangan. Unsur apa saja yang mempunyai kriteria tersebut?
PEMBAHASAN :
Memiliki elektron tidak berpasangan 3 elektron memiliki kemungkinan konfigurasinya:
[Ar] ns2 (n-1)d3 berada di Golongan VA atau
[Ar] ns2 (n-1)d7 berada di golongan Golongan VIIIB
Soal No.23
Bagan berikut ini merupakan potongan sistem periodik unsur yang tidak lengkap.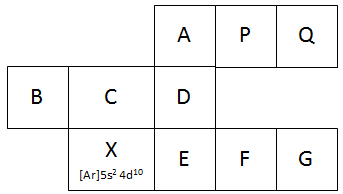
- Tentukanlah letak golongan dan periode dari unsur-unsur A, B, dan F
- Berapa elektron tidak berpasangan yang terdapat pada atom-atom B, D, dan G
- Atom manakah yang memiliki energi ionisasi terbesar?
- Atom manakah yang paling mudah menangkap elektron untuk membentuk ion negatif?
PEMBAHASAN :
- Golongan X yaitu golongan IIB Periode 5
Maka golongan A : IIIA, Periode :
Golongan B : IB, Periode: 4
Golongan F : IVB, Periode : 5 
- Unsur Q, paling kanan dan yang paling atas
- Unsur Q, paling kanan dan yang paling atas
Soal No.24
Berapa unsur yang terdapat dalam setiap periode pada blok f? Jelaskan.
PEMBAHASAN :
14 unsur karena pada sub kulit f maksimal diisi oleh 14 elektron
Soal No.25
Perhatikan tabel konfigurasi elektron dan harga ionisasi dari beberapa atom unsur periode ketiga dalam sistem periodik unsur (lihat tabel di bawah). Bila ditinjau dari besarnya jari-jari atom, maka sepanjang periode dari kiri ke kanan semakin kecil, tetapi harga energi ionisasinya tidak selalu semakin besar. Misalnya dari Mg ke Al dan dari P ke S. Mengapa perubahan harga energi ionisasi tidak sejalan dengan perubahan jari-jari atom?
Jika suatu unsur L memiliki nomor atom 27 dan nomor massa 58 maka pernyataan yang benar tentang unsur tersebut adalah ….
- L adalah logam transisi yang berada pada periode yang sama dengan unsur K
- L memiliki jumlah proton 27, neutron 27, dan elektron 31
- L termasuk unsur logam alkali tanah, periode 4, dan bisa membentuk basa L(OH)2
- L termasuk unsur nonlogam, periode 4 dan berada pada golongan yang sama dengan 45Rh
- L termasuk unsur logam alkali, periode 4 dan bersifat reduktor kuat
PEMBAHASAN :
- Konfigurasi unsur 27L :[Ar] 4s2 3d7
terletak pada periode 4. Sedangkan K konfigurasinya
19K : [Ar] 4s1
terletak pada periode keempat - Jumlah nomor atom = proton = elektron = 27
- Dari konfigurasi termasuk golongan VIIIB (transisi) periode 4 termasuk unsur logam
Pernyataan yang benar adalah pilihan A
Jawaban A
Soal No.28 (SNMPTN 2011)
Konfigurasi elektron ion X2+ yang memiliki bilangan massa 45 dan 24 neutron adalah …
- 1s2 2s2 2p6 3s2 3p6 4s2 3d1
- 1s2 2s2 2p6 3s2 3p6 4s1
- 1s2 2s2 2p6 3s2 3p6 3d1
- 1s2 2s2 2p6 3s2 3p6 4s2 3d2
- 1s2 2s2 2p6 3s2 3p6 4s2 3d3
PEMBAHASAN :
Menentukan nomor atom
A = Z + n
Z = A – n = 45 – 24 = 21
Maka konfigurasinya
21X : 1s2 2s2 2p6 3s2 3p6 4s2 3d1
X2+ artinya melepas 2 elektron sehingga konfigurasinya menjadi:
21X2+ : 1s2 2s2 2p6 3s2 3p6 3d1
Jawaban C
Soal No.29 (SNMPTN 2010)
Dalam Sistem Berkala Unsur, unsur X terletak pada periode ketiga dan golongan 15 atau VA. Dalam keadaan ion, unsur ini isoelektronik dengan unsur gas mulia periode ketiga. Muatan ion X adalah …
PEMBAHASAN :
Unsur X golongan VA memiliki elektron valensi 5 agar stabil seperti gas mulia, maka unsur tersebut harus menangkap 3 elektron agar elektron valensinya menjadi 8. Proses menangkap 3 elektron menyebabkan unsur tersebut menjadi ion bermuatan 3- atau menjadi ion X3-
Jawaban C
Soal No.30 (SNMPTN 2009)
Unsur yang mempunyai diagram elektron valensi pada keadaan dasar seperti berikut
adalah …
PEMBAHASAN :
diagram orbital tersebut berasal dari sub kulit s dan p, konfigurasinya
ns2 np3 maka elektron valensinya 5, yang memiliki konfigurasi demikian yaitu:
15P : 1s2 2s2 2p6 3s2 3p3
Jawaban C
Soal No.31 (SNMPTN 2008)
Dalam suatu atom, jumlah maksimum elektron yang memiliki bilangan kuantum n = 3 dan m = +1 adalah….
PEMBAHASAN :
memiliki bilangan kuantum n = 3 dan m = +1, berarti berada di kulit 3, yang memiliki m = +1 adalah sub kulit p dan d. Yang mungkin adalah sub kulit p karena ketika menempati m = +1 maka sub kulit p akan penuh sehingga jumlah elektron maksimumnya = 6. Sedangkan jika m = +1 di sub kulit d jika menempati m = +1 maka jumlah maksimum elektronnya adalah 9.
Jawaban C
Soal No.32 (SNMPTN 2008)
Nilai bilangan kuantum yang mungkin dalam suatu orbital adalah….
- n = 2 l = 1 m = 0
- n = 2 l = 2 m = 2
- n = 3 l = 3 m = 1
- n = 1 l = 3 m = 2
- n = 3 l = 0 m = 3
PEMBAHASAN :
n adalah kulit, l adalah sub kulit dan m adalah bilangan kuantum magnetik. Dari n kita dapat menentukan l maksimum yang dimiliki pada kulit tertentu dengan rumusan
l maks = (n – 1)
Sedangkan nilai m dapat ditentukan dari l menggunakan rumusan
m = – l s.d +l
Pilihan jawaban ada yang kulitnya n = 2 dan n = 3
Untuk n = 2, maksimal l nya adalah = 1, dan kemungkinan m adalah -1, 0 , +1
Untuk n = 3, maksimal l nya adalah = 2, dan kemungkinan m adalah -2, -1, 0 , +1, +2
Maka jawaban yang paling tepat adalah A
pada n = 2, l nya = 1 dan m = 0
Jawaban A
Soal No.33 (SPMB 2007)
Deret bilangan kuantum yang sesuai dengan elektron 3p adalah….
- n = 3 l = 0 m = 0 s = + ½
- n = 3 l = 1 m = 0 s = + ½
- n = 3 l = 1 m = 2 s = + ½
- n = 3 l = 2 m = 2 s = – ½
- n = 3 l = 3 m = 2 s = – ½
PEMBAHASAN :
Deret bilangan kuantun 3p
n = 3
l = 1
m = -1, 0, +1 ( bisa salah satunya)
s = + ½, – ½ (bisa salah satunya)
Jawaban yang paling tepat adalah pilihan B
Jawaban B
Soal No.34 (SPMB 2007)
Deret bilangan kuantum yang sesuai dengan elektron 3p adalah….
- n = 3 l = 0 m = 0 s = + ½
- n = 3 l = 1 m = 0 s = + ½
- n = 3 l = 1 m = 2 s = + ½
- n = 3 l = 2 m = 2 s = – ½
- n = 3 l = 3 m = 2 s = – ½
PEMBAHASAN :
Deret bilangan kuantun 3p
n = 3
l = 1
m = -1, 0, +1 ( bisa salah satunya)
s = + ½, – ½ (bisa salah satunya)
Jawaban yang paling tepat adalah pilihan B
Jawaban B
Soal No.35 (SPMB 2003)
Diketahui nomor atom Ca = 20, Cu = 29, K = 19, Ti = 22 dan Zn = 30. Ion-ion di bawah ini mempunyai elektron berpasangan, kecuali …
PEMBAHASAN :
Jawaban B
Soal No.36 (SPMB 2005)
Kalium isoeektronik dengan klorin (nomor atom K = 19; Cl = 17)
SEBAB
Ion kalium dan ion klorida memiliki konfigurasi yang sama
PEMBAHASAN :
Isoelektronik adalah atom atau ion yang memiliki jumlah elektron yang sama dan konfigurasinya sama. Atom kalium dengan klorin bukan isoelektronik karena beda jumlah elektronnya, kalium memiliki 19 elektron sedangkan klorin memiliki 17 elektron. Pernyataan SALAH. Sedangkan ion kalium dan ion klorida jika dikonfigurasikan:
19K+ : 1s2 2s2 2p6 3s2 3p6
17Cl— : 1s2 2s2 2p6 3s2 3p6
Keduanya memiliki konfigurasi dan jumlah elektron yang sama, sehingga dalam bentuk ionnya keduanya isoelektronik. Alasan BENAR
Jawaban D
Soal Sistem Periodik Unsur (SPU) Pilihan Ganda (PG) SBMPTN
Soal No.37 (SBMPTN 2018)
Energi ionisasi (kJ/mol) ke-1 sampai ke-5 untuk unsur X berturut-turut adalah 786, 1.580, 3.230, 4.360, dan 16.010. Senyawa yang dapat terbentuk dan stabil adalah….
PEMBAHASAN :
Energi ionisasi adalah energi yang diperlukan untuk melepaskan elektron. Semakin tinggi energi ionisasi maka semakin sulit melepas elektron. Pada energi ionisasi ke lima kenaikannya terlalu drastis. Sehingga dapat diperkirakan atom tersebut mampu melepas elektron sampai melepaskan 4 e sedangkan untuk melepaskan atom yang ke 5 terlalu sulit karena energi ionisasinya terlalu besar. Maka ion yang paling mungkin adalah X4+ jika di ikatkan dengan Cl— akan membentuk senyawa XCl4
Jawaban E
Soal No.38 (SBMPTN 2016)
Nilai energi pengion ke-1 sampai ke-5 untuk unsur X pada golongan utama berturut-turut adalah 509, 979, 3.300, 4.400, dan 5.700 kJ.mol-1. Berdasarkan data tersebut, dapat disimpulkan bahwa unsur X cenderung membentuk ion….
PEMBAHASAN :
Energi pengion merupakan energi yang diperlukan untuk melepaskan elektron. Semakin tinggi energi ionisasi maka semakin sulit melepas elektron. Pada energi ionisasi ke tiga mengalami kenaikan lebih tinggi. Sehingga dapat diperkirakan atom tersebut mampu melepas elektron sampai 2 e sedangkan untuk melepaskan atom yang ke 3 terlalu sulit karena energi ionisasinya terlalu besar. Maka ion yang paling mungkin adalah X2+
Jawaban B
Soal No.40 (SPMB 2002)
Unsur dengan keelektronegatifan tinggi mempunyai konfigurasi elektron pada keadaan dasar adalah …
- 1s2 2s2 2p1
- 1s2 2s2 2p6 3s1
- 1s2 2s2 2p6 3s2 3p5
- 1s2 2s2 2p6 3s2 3p6
- 1s2 2s2 2p6 3s2 3p6 3d10 4s1
PEMBAHASAN :
Unsur yang memiliki keelektronegatifan tinggi yaitu unsur yang menangkap sedikit elektron untuk mencapai kestabilan.
- e.v = 3 (melepas 3e)
- e. v = 1 (melepas 1e)
- e.v = 7 (menangkap 1e)
- e.v = 8 (sudah stabil)
- e.v = 11 (transisi, melepas e)
Unsur yang paling tinggi keelektronegatifannya adalah pilihan C
Jawaban C
Soal No.41 (UMPTN 1990)
Bagi unsur dengan konfigurasi elektron sebagai berikut:
1s2 2s2 2p6 3s2 3p6 3d7 4s2
berlaku pernyataan bahwa unsur tersebut…
- Mempunyai nomor atom 27
- Terletak pada periode 4
- Mempunyai 3 elektron tidak berpasangan
- Termasuk dalam golongan alkali tanah
PEMBAHASAN :
- jika dijumlahkan elektronnya = 2 + 2 + 6 + 2 + 6 + 7 + 2 = 27, maka benar nomor atomnya =27
- Karena kulit terluarnya berada pada kulit 4, maka benar periodenya = 4
- jika di tuliskan diagram orbitalnya
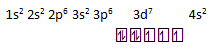
Maka benar jumlah elektron tidak berpasangannya ada 3 - Dari konfigurasi golongannya melibatkan sub kulit d yang tidak penuh maka golongan termasuk ke dalam logam transisi atau golongan B, yaitu golongan VIII B, jadi sala termasuk golongan alkali tanah
Maka jawaban yang benar adalah 1,2 dan 3
Jawaban A
Soal No.42 (SIMAK UI 2015)
Atom atau ion yang kulit terluarnya bukan ns2np3 dari atom-atom di bawah ini adalah … .
PEMBAHASAN :
- 7N : 1s2 2s2 2p3
- 15P : 1s2 2s2 2p6 3s2 3p3
- 35Br : [Ar] 4s2 3d10 4p5
35Br2+ : [Ar] 4s2 3d10 4p3 - 6C : 1s2 2s2 2p2
6C— : 1s2 2s2 2p3 - 82Pb : [Xe]6s2 4f14 5d10 6p2
82Pb+ : [Xe]6s2 4f14 5d10 6p1
Ion yang bukan termasuk ns2 np3 adalah Pb+
Jawaban E
Soal No.43 (SIMAK UI 2013)
Di antara unsur-unsur 4P, 19Q, 13R, 31S, 15T, 34U dan 53V, yang terletak dalam golongan yang sama pada sistem periodik adalah ….
- P dan R
- Q dan S
- Q dan V
- R dan S
- T dan U
PEMBAHASAN :
Konfigurasi masing-masing unsur:
4P : 1s2 2s2, e.v = 2 ⇒ Gol = II A
19Q : [Ar] 4s1, e.v = 1 ⇒ Gol = IA
13R : [Ne] 3s2 3p1, e.v = 3 ⇒ Gol = IIIA
31S : [Ar] 4s2 3d10 4p1, e.v = 3 v Gol = IIIA
15T : [Ne] 3s2 3p3, e.v = 5 ⇒ Gol = VA
34U : [Ar] 4s2 3d10 4p4, e.v = 6 ⇒ Gol = VIA
53V : [Kr] 5s2 4d10 5p5, e.v = 7 ⇒ Gol = VIIA
Pasangan unsur yang satu golongan adalah R dan S
Jawaban D
Soal No.44 (UM UGM 2008)
8A, 16B, 17C, 18D
Pernyataan yang benar
tentang unsur-unsur tersebut adalah ….
- unsur B memiliki jari-jari atom terbesar
- potensial ionisasi unsur D adalah yang terbesar
- unsur A lebih elektronegatif daripada unsur B
- elektronegatifitas unsur D adalah yang terbesar
PEMBAHASAN :
Menentukan golongan dan periode masing-masing unsur
8A : 1s2 2s2 2p4, Gol = VIA, Periode : 2
16B : 1s2 2s2 2p6 3s2 3p4, Gol = VIA, Periode : 3
17C : 1s2 2s2 2p6 3s2 3p5, Gol = VIIA, Periode : 3
18D : 1s2 2s2 2p6 3s2 3p6, Gol = VIIIA, Periode : 3
- Sifat jari-jari atom dalam satu golongan dari atas ke bawah semakin besar, dalam satu periode dari kiri ke kanan semakin kecil. Unsur yang paling besar jari-jarinya yang paling kiri dan paling bawah yaitu unsur B
- Sifat potensial ionisasi dalam satu golongan dari atas ke bawah semakin kecil, dalam satu periode dari kiri ke kanan semakin besar. Unsur yang paling besar potensial ionisasinya yang paling kanan dan paling atas yaitu unsur D
- Kecenderungan elektronegatif sama dengan potesial ionisasi sehingga unsur A akan lebih elektronegatif dibanding unsur B.
- Keelektronegatifan terbesar adalah unsur paling kanan yaitu golongan VIIIA. Tetapi, karena golongan VIIIA sudah stabil maka tidak memiliki ketertarikan terhadap elektron maka golongan VIIIA tidak memiliki keelektronegatifan.
Jawaban yang paling tepat adalah 1,2 dan 3
Jawaban A
Soal No.45 (UM UNDIP 2009)
Diketahui 5 unsur berikut:
Unsur yang mempunyai jari-jari atom terbesar adalah….
PEMBAHASAN :
Menentukan terlebih dahulu Golongan dan Periode masing-masing unsur
 : 1s2 2s2 2p1, Golongan IIIA periode 2
: 1s2 2s2 2p1, Golongan IIIA periode 2 : 1s2 2s2 2p6 3s2 , Golongan IIA periode 3
: 1s2 2s2 2p6 3s2 , Golongan IIA periode 3-
 : 1s2 2s2 2p6 3s2 3p4 , Golongan VIA periode 3
: 1s2 2s2 2p6 3s2 3p4 , Golongan VIA periode 3  : 1s2 2s2 2p6 3s2 3p6 4s1 , Golongan IA periode 4
: 1s2 2s2 2p6 3s2 3p6 4s1 , Golongan IA periode 4 : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5 , Golongan VIIA periode 4
: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5 , Golongan VIIA periode 4
Dari konfigurasi dan letak Golongan dan periode unsur yang jari-jarinya paling besar adalah K, karena kecenderungan jari-jari atom dalam SPU dalam satu periode dari kiri ke kanan makin kecil artinya golongan IA jari-jarinya paling besar.
Jawaban D
Soal No.46 (UM UNDIP 2009)
Energi ionisasi unsur ![]() lebih besar dari pada unsur
lebih besar dari pada unsur ![]() .
.
SEBAB
Unsur golongan VA lebih stabil daripada unsur golongan VI A
PEMBAHASAN :
Pernyataan benar, karena ![]() memiliki konfigurasi elektron yang stabil (setengah penuh) dibanding
memiliki konfigurasi elektron yang stabil (setengah penuh) dibanding ![]() , jika dikonfigurasikan
, jika dikonfigurasikan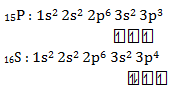
Karena lebih stabil maka P (Golongan VA) memiliki energi ionisasi yang lebih tinggi dibanding S (Golongan VI A). Alasan BENAR tapi tidak berhubungan
Jawaban B
Soal No.47 (UM UNDIP 2009)
Elektron terakhir dari suatu atom menempati bilangan kuantum n = 3, l = 1, m = 0, s = 1/2. Dalam tabel periodik unsur tersebut terletak pada….
- Golongan VA, periode 2
- Golongan IVA, periode 3
- Golongan VIIA, periode 2
- Golongan VIIA, periode 3
- Golongan VIIIA, periode 2
PEMBAHASAN :
Bilangan kuantum elektron terakhir terletak pada n = 3, l = 1, m = 0, s = 1/2, jika digambarkan diagram orbitalnya![]()
atau terakhir pada 3p2, jika dituliskan konfigurasi lengkapnya : 1s2 2s2 2p6 3s2 3p2
Maka letaknya yaitu pada golongan IVA dan periode = 3
Jawaban B
Ayo berlatih. Uji kemampuanmu. Klik link di bawah yah:
Latihan Soal
Semoga Bermanfaat