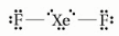Untuk Pembelajaran selanjutnya…
Soal No.1
Konfigurasi elektron atom X pada keadaan tereksitasi adalah [Ne] 3s2 3p2 4s1 3d1 . Konfigurasi elektron atom tersebut pada keadaan dasar adalah …
- [Ne] 3s2 3p3 4s1
- [Ne] 3s2 3p4
- [Ne] 3s2 3p3
- [Ne] 3s2 3p2
- [Ne] 3s2 3p1
Soal No.2
Kelimpahan 2 isotop atom Y adalah 30% dan 70% dengan massa berturut-turut 18 sma dan 20 sma. Jika atom Y dapat membentuk senyawa CaY2 (Ar Ca = 40), maka Mr CaY2 adalah …
- 76,0
- 77,2
- 78,0
- 78,8
- 80,0
Soal No.3
Molekul dengan perbedaan keelektronegatifan yang paling besar antar atom-atomnya adalah …
- ICI5
- IBr3
- BrCl3
- FBr5
- IF5
Senyawa XeF2 mem punyai struktur geometri berikut:
Diketahui symbol Lewis
Spesi berikut yang mempunyai struktur geometri sama dengan XeF2 adalah …
- SF2
- IF2 –
- NF2 –
- BrF2 +
- OF2
Soal No.5
Reaksi pembakaran etana terjadi sebagai berikut:
C2H4(g) + 3O2(g) → 2CO2(g) + 2H2O(I)
Volume gas CO2 yang dihasilkan dari pembakaran 50 mL gas etana dengan 300 ml gas O2 pada suhu dan tekanan tetap adalah …
- 50 mL
- 100 mL
- 150 mL
- 200 mL
- 300 mL
Soal No.6
Suatu senyawa organik mengandung unsur C, H, dan N. Pembakaran 1 mol senyawa tersebut menghasilkan 6 mol CO2 , 4 mol H2 O, dan 2 mol NO2 . Rumus empiris senyawa tersebut adalah …
- C3 H4 N
- C3 H5 N
- C3 H6 N
- C3 H9 N
- C6 H8 N
Soal No.7
Campuran gas He, gas Ne, dan gas Ar memiliki tekanan total 1,0 atm. Jika dalam campuran terdapat 2 mol gas He dengan tekanan parsial 0,5 atm, jumlah seluruh gas dalam campuran tersebut adalah …
- 2 mol
- 4 mol
- 6 mol
- 8 mol
- 10 mol
Data laju awal untuk reaksi (CH3 )3 CBr + OH – → (CH3 )3 COH + Br–
Pada 550 C diberikan pada tabel berikut:
| Konsentrasi Awal (M) | Laju awal (M/ detik) | |
| [(CH3 )3 CBr] | [OH – ] | |
| 0,1 | 0,1 | 0,02 |
| 0,2 | 0,1 | 0,04 |
| 0,3 | 0,1 | 0,06 |
| 0,1 | 0,2 | 0,02 |
| 0,1 | 0,3 | 0,02 |
Hukum laju reaksi ini adalah …
- r = k[(CH3)3CBr] [OH–]
- r = k[(CH3)3CBr]
- r = k[OH–]
- r = k[(CH3 )3CBr]2 [OH–]
- r = k[(CH3)3CBr] [OH–]2
Soal No.9
Pelarutan padatan MX2 terjadi sesuai kesetimbangan berikut:
MX2(s) ⇔ M2+(aq) + 2X–(aq)
Jika penguapan 100 mL larutan jenuh MX2 menghasilkan 1 mmol padatan MX2 , nilai Ksp senyawa tersebut adalah …
- 1 x 10 -4
- 4 x 10 -4
- 1 x 10 -6
- 4 x 10 -6
- 1 x 10 -8
Soal No.10
Suatu larutan buffer asam diketahui mengandung 3 mol HA dengan tetapan ionisasi Ka dan 1 mol NaA. Jika ke dalam larutan ini ditambahkan 1 mol NaOH, nilai pH larutan yang terbentuk adalah …
- pH = pKa – log 3
- pH = pKa – log 2
- pH = pKa
- pH = pKa + log 2
- pH = pKa + log 3
Soal No.11
Elektrolisis larutan yang mengandung ion WO42- selama 965 detik menghasilkan 0,005 mol logam wolfram (W) di katoda. Besarnya arus yang digunakan dalam elektrolisis ini adalah …
(F = 96500 C/mol)
- 0,5 A
- 1,0 A
- 1,5 A
- 2,5 A
- 3,0 A
Soal No.12
Pada ion S – C ≡ N– , orbital hibrida yang digunakan untuk berikatan oleh atom N adalah …
- sp
- sp2
- sp3
- sp3 d
- sp3 d2
Semoga Bermanfaat