pembahasan selanjutnya adalah

Pembahasan soal-soal Ujian Nasional (UN) SMA-IPA bidang studi Kimia dengan materi pembahasan Sel Elektrolisis dan Hukum Faraday.
Soal Sel Elektrolisis dan Hukum Faraday UN 2015
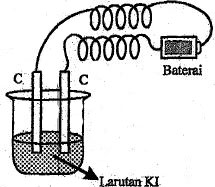
Reaksi yang terjadi di katoda adalah ….
A. C(s) + O2(g) → CO2(g)
B. K+(aq) + e → K(s)
C. 2H2O(l) + 2e → H2(g) + 2OH−(aq)
D. 2I−(aq) → I2(s) + 2e
E. 4OH−(aq) → 2H2O(l) + O2(g) + 4e
Pembahasan
Reaksi yang terjadi di katoda hanya bergantung pada jenis logam yang terkandung dalam larutan yang digunakan. Sel elektrolisis di atas menggunakan larutan KI, berarti menggunakan logam K (kalium).
Logam K termasuk golongan utama, tepatnya golongan IA. Bila logam yang digunakan adalah logam golongan utama maka pada katoda terjadi reduksi air (H2O).
2H2O + 2e → H2 + 2OH−
Jadi, reaksi yang terjadi di katoda adalah opsi (C).
Soal Sel Elektrolisis dan Hukum Faraday UN 2013
Proses elektrolisis lelehan NaCl dengan elektroda karbon digunakan arus sebesar 10 ampere selama 30 menit. Massa logam natrium yang diperoleh adalah …. (Ar Na = 23, Cl = 35,5)
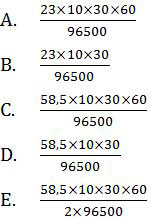

Pembahasan
Meskipun kation yang digunakan (Na+) berasal dari logam golongan utama, tetapi tidak akan terjadi reduksi air karena yang digunakan adalah lelehan (bukan larutan). Logam Na akan dihasilkan di katoda menurut reaksi:
Na+ + e → Na
Massa endapan logam natrium dapat ditentukan dengan menggunakan hukum I Faraday.
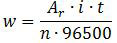
dengan
Ar : massa atom relatif Na = 23
i : arus listrik yang digunakan = 10 ampere
t : waktu yang dibutuhkan dalam detik = 30 × 60 detik
n : koefisien elektron = 1
Dengan memasukkan data-data di atas pada rumus hukum I Faraday diperoleh
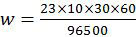
Jadi, massa logam natrium yang dihasilkan dari elektrolisis lelehan NaCl tersebut adalah opsi (A).
Soal Sel Elektrolisis dan Hukum Faraday UN 2012
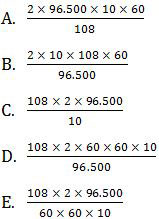
Pembahasan
Perak akan diendapkan di katoda menurut reaksi:
Ag+ + e → Ag
Massa perak yang dihasilkan dapat dicari dengan menggunakan hukum I Faraday.
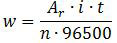
dengan
Ar : massa atom relatif Ag =108
i : arus listrik yang digunakan = 10 ampere
t : waktu yang dibutuhkan dalam detik = 2 × 60 × 60 detik
n : koefisien elektron = 1
Nah, sekarang tinggal memasukkan data-data tersebut pada rumus hukum I Faraday. Diperoleh:
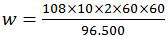
Jadi, massa perak yang mengendap adalah opsi (D).
Soal Sel Elektrolisis dan Hukum Faraday UN 2014
A. 6,35 gram
B. 1,27 gram
C. 0,64 gram
D. 0,32 gram
E. 0,127 gram
Pembahasan
Kita tentukan dulu reaksi yang terjadi di katoda dan anoda. Kation pada larutan CuSO4 adalah Cu2+ (bukan logam dari golongan utama) sehingga di katoda terjadi reduksi kation. Sedangkan anionnya, SO42− (mengandung O) sehingga di anoda terjadi oksidasi air.
(1) katoda : Cu2+ + 2e → Cu
(2) anoda : 2H2O → 4K+ + 4e + O2
Disebutkan pada soal bahwa di anoda dihasilkan gas 224 ml, berarti yang dimaksud adalah gas oksigen (O2). Sedangkan yang ditanyakan adalah massa endapan di katoda, berarti endapan Cu. Karena diketahui data pada anoda dan ditanyakan data pada katoda maka harus menggunakan hukum II Faraday.
mol1n1 = mol2n2
(indeks 1 mewakili katoda dan indeks 2 mewakili anoda, n adalah jumlah elektron)
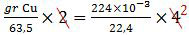
gr Cu = 2 × 10−2 × 63,5
= 1,27
Jadi, massa endapan Cu yang diperoleh di katoda adalah 1,27 gram (B).
Soal Sel Elektrolisis dan Hukum Faraday UN 2015
A. 7,94 gram
B. 15,88 gram
C. 23,82 gram
D. 31,75 gram
E. 39,69 gram
Pembahasan
Adanya kalimat ‘dihubungkan secara seri’ memberitahukan kepada kita bahwa soal di atas harus diselesaikan dengan hukum II Faraday. Anggap saja indeks (1) mewakili Cu (tembaga) dan indeks (2) mewakili seng (Zn), diperoleh:
mol1n1 = mol2n2
Sementara itu, valensi Cu sama dengan valensi Zn (sama-sama 2, Cu2+ dan Zn2+) sehingga n1 = n2. Diperoleh:
mol1 = mol2
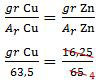
gr Cu = ¼ × 63,5
= 15,875
Jadi, banyaknya tembaga (Cu) yang mengendap adalah 15,88 gram (B).
Pembahasan soal Sel Elektrolisis dan Hukum Faraday yang lain bisa disimak di:
Pembahasan Kimia UN 2014 No. 35
Pembahasan Kimia UN 2015 No. 32 dan 33
Pembahasan Kimia UN 2016 No. 19
Pembahasan Kimia UN 2017 No. 34
Pembahasan Kimia UN 2018 No. 21 dan 23
Pembahasan Kimia UN 2018 No. 27
Pembahasan Kimia UN 2019 No. 26
Simak juga:
Pembahasan Kimia UN: Reaksi Redoks dan Elektrokimia.
Pembahasan Kimia UN: Korosi
Dapatkan pembahasan soal dalam file pdf di sini.
Terimakasih
Semoga Bermanfaat
