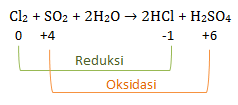Untuk Pembelajaran selanjutnya…
Pengertian Reaksi Reduksi dan Oksidasi (Redoks)
- Reaksi reduksi :
- Reaksi pelepasan oksigen
Contoh:
3Fe2O3 → 6Fe + 3O2 - Reaksi penangkapan elektron
Contoh:
F2 + 2e− → 2F− - Penurunan biloks
Contoh:
Cl2 → 2Cl− + 2e−
biloks Cl turun dari 0 menjadi -1
- Reaksi pelepasan oksigen
- Reaksi oksidasi :
- Reaksi penangkapan oksigen
Contoh:
C + O2 → CO2 - Reaksi pelepasan elektron
Na → Na+ + e− - Kenaikan biloks
Contoh: 2FeCl2 + Cl2 → 2FeCl3
biloks Fe naik dari +2 menjadi +3
- Reaksi penangkapan oksigen
Bilangan Oksidasi (Biloks)
- Merupakan bilangan yang menyatakan muatan suatu atom dalam suatu molekul atau ion.
-
Aturan biloks:
a. biloks unsur bebas = 0, contoh unsur bebas : H2, O2, Na, Fe, P4
b. jumlah biloks atom dalam senyawa netral = 0
c. jumlah biloks atom dalam ion = muatan ion
-
Prioritas biloks :
IA : Li, Na, K, Rb, Cs, B.O = +1
IIA : Be, Mg, Ca, Sr, Ba, B.O = +2
Al, B.O = +3
F, B.O = -1
H, B. O = +1
O, B.O = -2
S, B.O = -2
VII A : Cl, Br, I, B.O = -1
Keterangan: Unsur yang lebih atas di dahulukan dimasukan nilai biloksnya.
Contoh Menentukan Biloks:
Contoh I:
Senyawa netral
H2SO4
(unsur S berada paling bawah di prioritas sehingga akan menjad unsur yang ditanyakan)
b.o H x 2 + b.o S x 1 + b.o O x 4 = 0
+1 x 2 + b.o S + (-2) x 4 = 0
2 – 8 + b.o S = 0
b.o S – 6 = 0
b.o S = +6
Contoh II :
Ion poliatomik
PO43-
(Karena P tidak ada di prioritas biloks, maka menjadi unsur yang ditanyakan biloksnya)
b.o P x 1 + b.o O x 4 = -3
b.o P + (-2) x 4 = -3
b.o P − 8 = -3
b.o P = -3 + 8 = +5
Reduktor, oksidator, hasil reduksi dan hasil oksidasi
- Reduktor atau pereduksi adalah zat yang menyebabkan zat lain mengalami reduksi. Reduktor/pereduksi sendiri mengalami reaksi oksidasi.
- Oksidator atau pengoksidasi adalah zat yang menyebabkan zat lain mengalami oksidasi. Oksidator/pengoksidasi sendiri mengalami reaksi reduksi.
- hasil reduksi merupakan hasil reaksi atau produk dari reaksi reduksi
- hasil oksidasi merupakan hasil reaksi atau produk dari reaksi oksidasi
Contoh:

Maka:
Reduktor : SO2
Oksidator : Cl2
Hasil reduksi : HCl
Hasil oksidasi : H2SO4
Reaksi Autoredoks/Disproporsionisasi dan reaksi anti autoredoks/konproporsionisasi
- Reaksi autoredoks/disproporsionisasi merupakan reaksi redoks dimana satu zat mengalami reaksi reduksi dan oksidasi sekaligus.
Contoh:
I2 mengalami reduksi sekaligus oksidasi - Reaksi autoredoks/disproporsionisasi merupakan reaksi redoks dimana satu zat mengalami reaksi reduksi dan oksidasi sekaligus.
Contoh:
S merupakan hasil reduksi sekaligus hasil oksidasi
Soal No.1
Tentukan bilangan oksidasi atom Mn pada senyawa:
PEMBAHASAN :
- b.o Mn = 0
- b.o Mn + b.o O x 2 = 0
b.o Mn + (-2) x 2 = 0
b.o Mn = +4 - MnSO4 → Mn2+ + SO42-
b.o Mn = +2 - b.o Mn + b.o O x 4 = -1
b.o Mn + (-2) x 4 = -1
b.o Mn = +8 – 1 = +7 - b.o Mn + b.o O x 4 = -2
b.o Mn + (-2) x 4 = -2
b.o Mn = +8 – 2 = +6
Soal No.2
Tentukan bilangan oksidasi setiap atom pada senyawa/ ion di bawah ini:
- N2O3
- NaNO3
- K2Cr2O7
- CrO42-
- PO43-
PEMBAHASAN :
- b.o N x 2 + b.o O x 3 = 0
2.b.o N + (-2) x 3 = 0
b.o N = +6/2 = + 3 - b.o Na x 1 + b.o N x 1 + b.o O x 3 = 0
+1 + b.o N + (-2) x 3 = 0
b.o N = +6 – 1 = +5 - b.o K x 2 + b.o Cr x 2 + b.o O x 7 = 0
+2 + 2. b.o Cr + (-2) x 7 = 0
2.b.o Cr = +14 – 2 = +12
b.o Cr = +12/2 = +6 - b.o Cr + b.o O x 4 = -2
b.o Cr + (-2) x 4 = -2
b.o Cr = +8 – 2 = + 6 - b.o P + b.o O x 4 = -3
b.o P + (-2) x 4 = -3
b.o P = +8 – 3 = +5
Soal No.3
Termasuk reaksi reduksi atau oksidasikah perubahan berikut?
- MnO4— → Mn2+
- SO32- → SO42-
- VO+ → VO2+
- Fe3+ → Fe2+
PEMBAHASAN :
- MnO4— → Mn2+
+7 +2 Terjadi penurunan bilangan oksidasi maka termasuk reduksi - SO32- → SO42-
+4 +6 Terjadi kenaikan bilangan oksidasi maka termasuk oksidasi - VO+ → VO2+
+3 +5 Terjadi kenaikan bilangan oksidasi maka termasuk oksidasi - Fe3+ → Fe2+
+3 +2 Terjadi penurunan bilangan oksidasi maka termasuk reduksi
Soal No.4
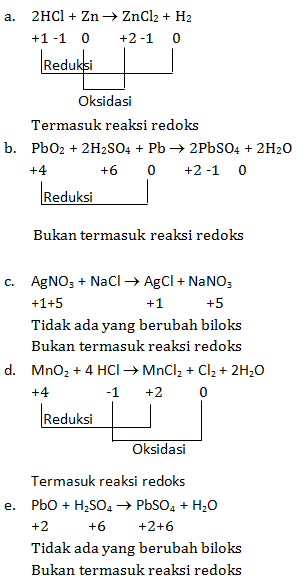
Apakah reaksi-reaksi di bawah ini termasuk reaksi redoks?
- 2HCl + Zn → ZnCl2 + H2
- PbO2 + 2H2SO4 + Pb → 2PbSO4 + 2H2O
- AgNO3 + NaCl → AgCl + NaNO3
- MnO2 + 4 HCl → MnCl2 + Cl2 + 2H2O
- PbO + H2SO4 → PbSO4 + H2O
Soal No.5
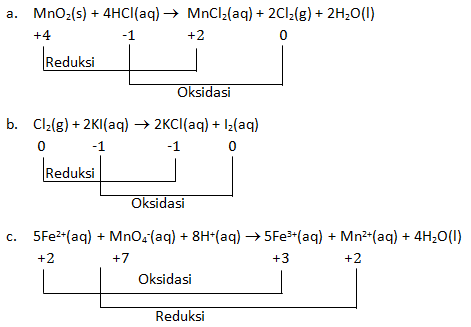
Tunjukan reaksi oksidasi dan reaksi reduksi dari persamaan reaksi berikut
- MnO2(s) + 4HCl(aq) → MnCl2(aq) + 2Cl2(g) + 2H2O(l)
- Cl2(g) + 2KI(aq) → 2KCl(aq) + I2(aq)
- 5Fe2+(aq) + MnO4—(aq) + 8H+(aq) → 5Fe3+(aq) + Mn2+(aq) + 4H2O(l)
Soal No.6
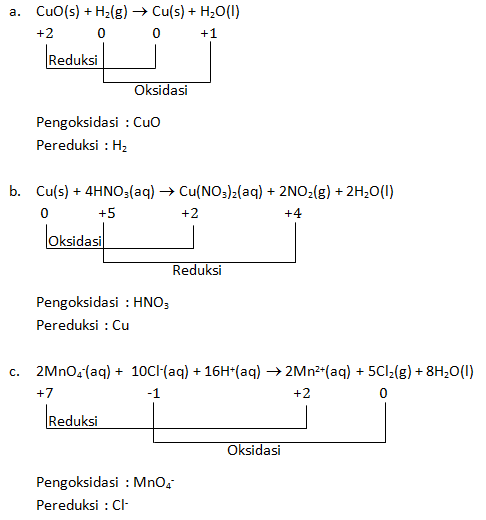
Tunjukkan reaksi oksidasi dan reduksinya, serta pengoksidasi dan pereduksinya
- CuO(s) + H2(g) → Cu(s) + H2O(l)
- Cu(s) + 4HNO3(aq) → Cu(NO3)2(aq) + 2NO2(g) + 2H2O(l)
- 2MnO4—(aq) + 10Cl—(aq) + 16H+(aq) → 2Mn2+(aq) + 5Cl2(g) + 8H2O(l)
Soal No.7
Tentukan bilangan oksidasi (biloks) setiap atom pada senyawa/ion di bawah ini:
- NH4NO3
- H2O2
- N2O3
- MnO42-
- PO43-
PEMBAHASAN :
- NH4NO3, senyawa harus dibagi dua dulu, sesuai ion yang terbentuk
NH4NO3 → NH4+ + NO3—
Menentukan b.o N dalam NH4+
b.o N x 1 + b.o H x 4 = +1
b.o N + (1) x 4 = +1
b.o N = -3
Menentukan b.o N dalam NO3—
b.o N x 1 + b.o O x 3 = -1
b.o N + (-2) x 3 = -1
b.o N = +5 - H2O2
b.o H x 2 + b.o O x 2 = 0
(+1) x 2 + b.o O x 2 = 0 (masukan pertama kali b.o H karena prioritas lebih tinggi
2b.o O = -2
b.o O = -1 - N2O3
b.o N x 2 + b.o O x 3 = 0
b.o N x 2 + (-2) x 3 = 0
b.o N x 2 – 6 = 0
2b.o N = +6
b.o N = +3 - MnO42-
b.o Mn x 1 + b.o O x 4 = -2
b.o Mn + (-2) x 4 = -2
b.o Mn – 8 = -2
b.o Mn = +6 - PO43-
b.o P x 1 + b.o O x 4 = -3
b.o P + (-2) x 4 = -3
b.o P – 8 = -3
b.o P = +5
Soal No.8
Tentukan oksidator, reduktor, hasil oksidasi dan hasil reduksi pada reaksi redok berikut
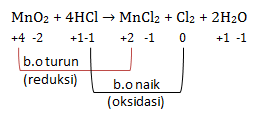
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
- MnO2 mengalami penurunan biloks sehingga mengalami reaksi reduksi atau sebagai OKSIDATOR
- HCl mengalami kenaikan biloks sehingga mengalami reaksi oksidasi atau sebagai REDUKTOR
- hasil oksidasi adalah zat di produk akibat mengalami reaksi oksidasi yaitu Cl2
- hasil reduksi adalah zat di produk akibat mengalami reaksi reduksi yaitu MnCl2
Soal No.9
Tentukan apakah reaksi berikut termasuk reaksi redoks atau bukan
a. AgNO3 + NaCl → AgCl + NaNO3
b. Cl2 + 2KI → 2KCl + I2
PEMBAHASAN :
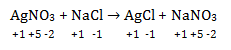 tidak ada zat yang mengalami kenaikan atau penurunan biloks sehingga bukan termasuk reaksi redoks
tidak ada zat yang mengalami kenaikan atau penurunan biloks sehingga bukan termasuk reaksi redoks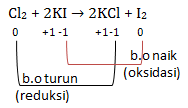 Termasuk reaski redoks karena ada zat yang mengalami kenaikan dan penurunan biloks
Termasuk reaski redoks karena ada zat yang mengalami kenaikan dan penurunan biloks
Soal No.10
Diketahui persamaan reaksi redoks
KMnO4(aq) + KI(aq) + H2SO4(aq) → MnSO4(aq) + I2(aq) + K2SO4(aq) +H2O(l)
Dari reaksi tersebut tentukan oksidator, reduktor hasil reduksi dan hasil oksidasi.
PEMBAHASAN :

Reduktor = KI
Oksidator = KMnO4
Hasil reduksi = MnSO4
Hasil Oksidasi = I2
Semoga Bermanfaat