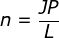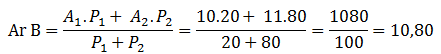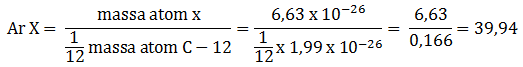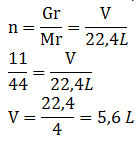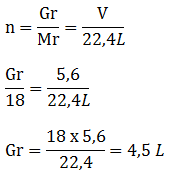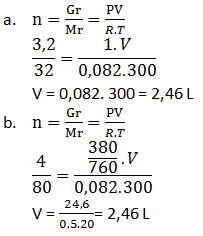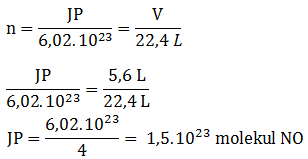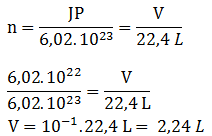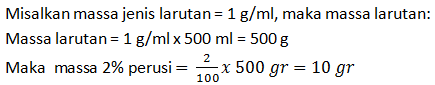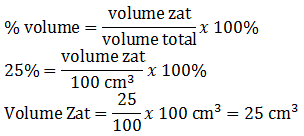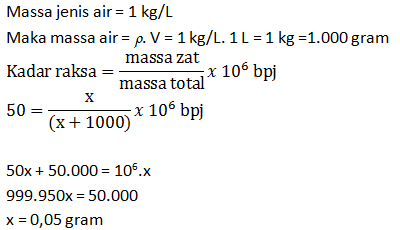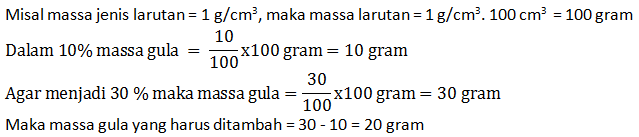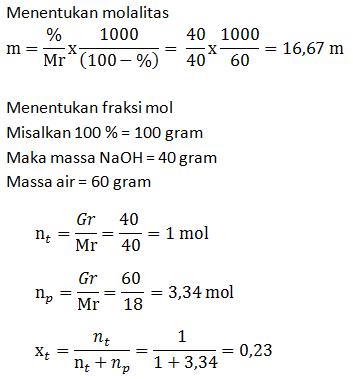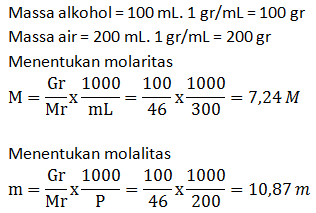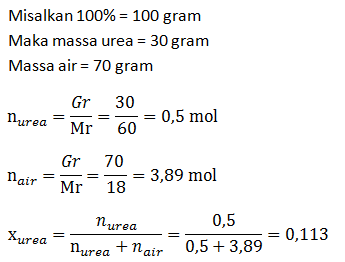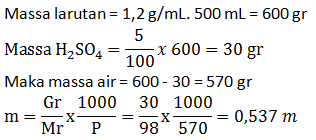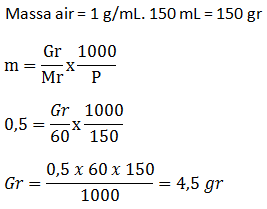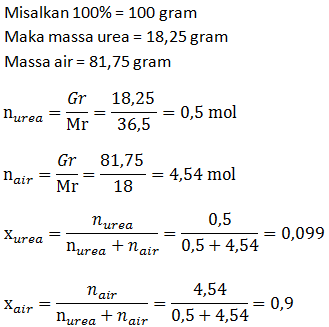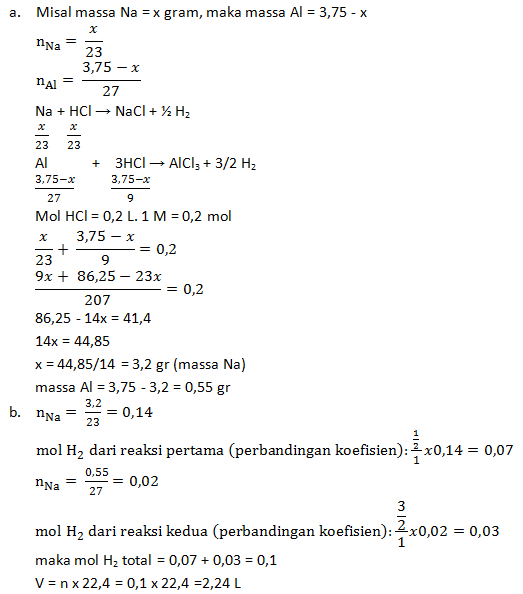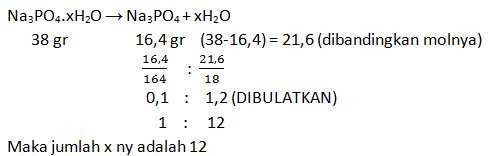Untuk Pembelajaran selanjutnya…
Lanjut lagi kita akan belajar bab konsep mol & stoikiometri. Bab ini penting kamu pelajari untuk menguasai materi selanjutnya di kimia terutama yang berkaitan dengan perhitungan. Jadi simak yah rangkuman materi dan contoh soal konsep mol & stoikiometri buat kamu kelas 10. Jika ingin lebih paham kita buatkan juga video pembelajarannya disini. Selamat belajar
Mol merupakan satuan jumlah yang digunakan para ahli kimia untuk menentukan jumlah zat.
Satuan jumlah yang sering digunakan dalam kehidupan sehari-hari misalnya:
1 Lusin = 12 buah
1 mol = 6,02 x 1023 partikel zat
Bila terdapat 1 mol molekul H2O maka terdapat 6,02 x 1023 molekul H2O
Bila terdapat 1 mol atom Fe maka terdapat 6,02 x 1023 atom Fe
Rumusan Mol
Hubungan mol (n) dengan Jumlah Parikel (JP)
Dijelaskan bahwa 1 mol terdapat 6,02 x 1023 atau jika dibuat rumusan:![]() atau JP = n x L
atau JP = n x L
Keterangan:
n = mol
JP = Jumlah partikel
L = bilangan avogadro (6,02 x 1023)
Contoh Soal:
- Tentukan jumlah mol Fe dari 3,01 x 1022 atom Fe!
- Tentukan Jumlah molekul H2O dari 1,5 mol H2O!
- Tentukan Jumlah atom N dari 2 mol NH3!
- Tentukan Jumlah atom total dari 4 mol H2SO4!
Jawaban:
 ,
, 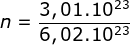 = 0,5 mol
= 0,5 mol- JP = n x L ; JP = 1,5 mol x 6,02 x 1023 molekul ; JP = 9,03 x 1023
- Untuk menentukan jumlah atom jika diketahui mol molekulnya menggunakan rumus JP = a x n x L
Keterangan:
JP = Jumlah atoma = Jumlah atom yang ditanyakan pada rumus molekul
n = mol
L = Bilangan Avogadro (6,02 x 1023)
Maka jumlah atom N dari 2 mol NH3 adalah:
JP = a x n x L
JP = 1 x 2 mol x 6,02 x 1023
JP = 12,04 x 1024 - Menggunakan rumus yang sama dengan no.3
JP = a x n x L
JP = 7 x 4 mol x 6,02 x1023
JP = 168,56 x 1023 = 1,68 x 1025
Hubungan mol dengan massa/gram
Massa molar (Mm) merupakan massa suatu zat jika jumlahnya 1 mol. Jika jumlahnya bukan 1 mol massa zat dapat dihitung dengan rumus:
![]() atau Gram = n x Mm
atau Gram = n x Mm
Massa molar atom akan sama dengan massa atom relatifnya (Ar)
Massa molar molekul akan sama dengan massa molekul relatifnya (Mr), sehingga rumusnya bisa berubah menjadi:
![]() atau Gram = n x Ar/Mr
atau Gram = n x Ar/Mr
Menentukan Ar bisa dilihat di SPU, nilai Ar sama dengan A (massa atom)
Menentukan Mr bisa dihitung dari penjumlahan Ar unsur penyusunnya dikali jumlah atomnya masing-masing. Contoh:
Mr H2SO4 = Ar H x 2 + Ar S x 1 + Ar O x 4
Mr Na3PO4 = Ar Na x 3 + Ar P x 1 + Ar O x 4
Contoh Soal:
1. Diketahui 46 gram logam Na tentukan jumlah molnya diketahui Ar Na =23!
2. Tentukan massa dari 2 mol CaCO3 jika diketahui (Ar Ca = 40, Ar C =12, Ar O =16)
Jawaban:
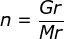 ;
; 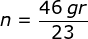 ; n = 2 mol
; n = 2 mol- Gram = n x Ar/Mr
Gr = 2 x Mr CaCO3
Mr CaCO3 = Ar Ca x 1 + Ar C x 1 + Ar O x 3 = 40 x 1 + 12 x 1 + 16 x 3 = 40 + 12 + 48 = 100
Gr = 2 x Mr CaCO3
Gr = 2 x 100
Gr = 200 gram
Hubungan mol dengan Volume pada kondisi STP (Standar Temperature and Pressure)
Kondisi STP merupakan kondisi standar dimana pada kondisi tersebut Tekanannya (P) = 1 atm dan suhunya (T) = 0C. Volume (V) pada kondisi STP untuk 1 mol nilainya 22,4 Liter sedangkan selain 1 mol volumenya dapat dihitung dengan rumus:
![]() atau V = n x 22,4 L
atau V = n x 22,4 L
Keterangan : V = volume (Liter)
Tambahan : 1 Liter = 1000 mL
Contoh Soal:
- Berapa jumlah mol 44,8 L gas oksigen yang diukur pada keadaan standar?
- Berapa Liter volume 0,5 mol gas hidrogen jika diukur pada keadaan STP?
Jawaban:
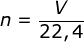 ;
; 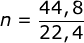 ; n = 2 mol
; n = 2 mol- V = n x 22,4 L ; V = 0,5 mol x 22,4 L ; V = 11,2 L
Hubungan mol dengan Volume pada kondisi Non STP
Kondisi Non STP merupakan kondisi dimana Tekanannya (P) tidak sama dengan 1 atm atau suhunya (T) tidak sama dengan 0C. Volume dan mol dapat dihitung dengan rumus:
![]() atau
atau ![]()
Keterangan:
V = Volume (Liter)
P = Tekanan (atm) jika dikonversi 1 atm = 76 cmHg atau 1 atm = 760 mmHg
n = mol
R = Tetapan gas umum ( 0,082 Latm/kmol)
T = Suhu (Kelvin) jika dikonversi dari celcius maka Kelvin = celcius + 273
Contoh Soal:
Berapa Volume 2 mol N2 jika diukur pada suhu 25 C dan tekanan 1 atm?
Jawaban:
T = 25C + 273 = 298 K
![]() ;
; ![]() ; V = 48,87 Liter
; V = 48,87 Liter
Hubungan mol dengan koefisien
Berdasarkan rumusan mol dapat dijelaskan bahwa:
Perbandingan jumlah mol akan sama dengan perbandingan jumlah partikelnya
Misalnya:
1 Mol O2 : 2 Mol = 6,02 x 10 23 molekul O2 : 12,04 x 10 23 molekul O2
Perbandingannya sama yaitu 1 : 2
Telah dijelaskan pada hukum avogadro bahwa:
Perbandingan jumlah partikel akan sama dengan perbandingan koefisien.
Dari rumusan di atas diperoleh kesimpulan :
Perbandingan Mol = Perbandingan Koefisien
N2(g) + 3 H2(g) → 2NH3(g)
1 mol 3 mol 2 mol
atau
2 mol 6 mol 4 mol
Atau bisa dicari dengan rumus:

Contoh soal I:
Pada reaksi pembentukan gas amonia (NH3) dari gas nitrogen dan hidrogen digunakan 5 mol nitrogen, sesuai reaksi:
N2(g) + H2(g) → NH3(g) (belum setara)
Tentukan:
- Jumlah mol gas hidrogen
- Jumlah mol amonia (NH3)
Jawaban:
Langkah-langkah:
Setarakan persamaan reaksinya.
N2(g) + 3 H2(g) → 2NH3(g)
Tentukan mol yang dicari dengan perbandingan koefisien.
Mol yang diketahuinya adalah milik N2 sebanyak 5 mol.

Atau cara langsung:
N2(g) + 3 H2(g) → 2NH3(g)
5 mol 2/1 x 5 mol = 10 mol
Contoh soal II:
Jika 8,8 g C3H8 dibakar dengan gas oksigen dihasilkan sejumlah gas CO2 dan uap air.(Ar O =16) Tentukan Massa gas O2 yang diperlukan
Jawaban :
Langkah-langkah :
Setarakan Persamaan Reaksinya
C3H8 + 5O2 → 3CO2 + 4H2O
Ubah data yang yang diketahui di soal ke dalam bentuk mol
Diketahui di soal adalah massa C3H8 = 8,8 gr maka ubah ke bentuk mol dengan rumus:
![]() ;
; ![]() ; n = 0,2 mol
; n = 0,2 mol
Tentukan mol yang dicari dengan perbandingan koefisien.
Cara langsung:
C3H8 + 5O2 → 3CO2 + 4H2O
0,2 mol 5 / 2 x 0,2 = 0,5 mol
Jadi mol O2 adalah 0,5 mol
Ubah mol ke dalam bentuk yang di tanyakan
Di soal ditanyakan massa O2 dapat dicari dengan mengubah mol ke dalam bentuk massa dengan rumus:
Gram = n x Mr ; Gram = 0,5 x 32 ; Gram = 16 gram
Jadi massa O2 yang terbentuk adalah 16 gram
- Part 1
- Part 2
- Part 3
- Part 4
Soal No.1
Boron di alam mempunyai dua isotop, yaitu B-10 dengan massa atom 10 sma sebanyak 20% dan B-11 dengan massa atom 11 sma sebanyak 80%. Berapakah massa rata-rata 1 atom B?
Soal No.2
Tembaga di alam terdapat dalam dua isotop, yaitu Cu-63 dan Cu-65. Jika massa atom relatif (Ar Cu = 63,5); tentukan kelimpahan masing-masing isotop tersebut di alam
Soal No.3
Jika massa 1 atom C-12 adalah 1,99 x 10-26 kg dan massa 1 atom X adalah 6,63 x 10-26 kg, tentukan Ar X
Soal No.4
Hitunglah Mr dari zat-zat berikut ini.
- P4
- Fe2(SO4)3
- Ca3(PO4)2
- KAl(SO4)2. 12H2O
- K4Fe(CN)6
PEMBAHASAN :
- Mr P4 = Ar P x 4 = 31 x 4 = 124
- Mr Fe2(SO4)3 = Ar Fe x 2 + Ar S x 3 + Ar O x 12 = 56 x 2 + 32 x 3 + 16 x 12 = 400
- Mr Ca3(PO4)2 = Ar Ca x 3 + Ar P x 2 + Ar O x 8 = 40 x 3 + 31 x 2 + 16 x 8 = 310
- Mr KAl(SO4)2. 12H2O = Ar K x 1 + Ar Al x 1 + Ar S x 2 + Ar O x 8 = 39 x 1 + 27 x 1 + 32 x 2 + 16 x 8 = 258
- Mr K4Fe(CN)6 = Ar K x 4 + Ar Fe x 1 + Ar C x 6 + Ar N x 6 = 39 x 4 + 56 x 1 + 12 x 6 + 14 x 6 = 368
Soal No.5
Bila Mr L(OH)3 = 78 dan Ar H = 1, O = 16, tentukanlah Ar L
PEMBAHASAN :
Mr L(OH)3 = Ar L x 1 + Ar O x 3 + Ar H x 3
78 = Ar L + 16 x 3 + 1 x 3
78 = Ar L + 51
Ar L = 78 – 51 = 27
Soal No.6
Suatu senyawa mempunyai rumus empiris CH3. Jika Mr senyawa tersebut 30, tentukan rumus molekul dari senyawa tersebut.
PEMBAHASAN :
Menentukan rumus molekul
(Mr RE)n = Mr senyawa
(12 x 1 + 1 x 3)n = 30
(15)n =30
n = 30/15 = 2
maka rumus molekulnya : (CH3)2 = C2H6
Soal No.7
Hitunglah jumlah partikel dari zat-zat berikut
- 2 gram gas H2 (Ar H = 1)
- 4 gram grafit (C) (Ar C = 12)
- 36 gram H2O (Ar H = 1, O = 16)
Soal No.8
Hitunglah massa masing-masing zat berikut
- 12,04 x 1022 molekul gas NH3 (ar N = 14, H =1)
- 3,01 x 1023 atom Pb (Ar Pb = 207)
- 1,204 x 1022 molekul S8 (Ar S = 32)
Soal No.9
Hitunglah volume 11 gram gas CO2 diukur pada 0oC dan tekanan 1 atm (Ar C = 12, O = 16)
Soal No.10
Berapa gram massa 5,6 liter uap air pada keadaan STP (Ar H = 1, O = 16)
Soal No.11
Hitunglah volume dari gas-gas berikut
- 3,2 gram gas O2 diukur pada 27oC, 1 atm
- 4 gram gas SO3 diukur pada 27oC dan tekanan 380 mmHg (Ar S = 32, O = 16)
Soal No.12
Hitunglah massa dari gas-gas berikut
- 1,23 liter gas CH4 diukur pada 25oC dan tekanan 1 atm (Ar C = 12, H = 1)
- 10 liter gas butana (CH4) diukur pada 25oC dan tekanan 100 atm
Soal No.13
Berapa molekul gas NO yang menempati ruang 5,6 liter diukur pada 0oC, 1 atm? (Ar N = 14, O = 16)
Soal No.14
Bila 1 liter gas NO massanya 1 gram, berapa gram massa 2 liter gas O2 jika diukur pada suhu dan tekanan yang sama?
PEMBAHASAN :
Soal No.15
Suatu tabung dengan volume tertentu berisi 12 kg gas O2. Tabung tersebut dikosongkan, kemudian pada suhu dan tekanan yang sama isinya diganti dengan gas CH4. Berapa massa gas CH4 yang ada di dalam tabung tersebut? (Ar C = 12, O = 16)
Soal No.16
Hitunglah volume yang ditempati oleh 6,02 x 1022 molekul gas CO diukur pada 0oC 1 atm
Soal No.17
Di dalam ruangan 5,6 liter (STP) terdapat gas NO. Berapa massa dan jumlah molekul gas NO tersebut? (Ar N = 14, O =16)
Soal No.18
Suatu senyawa mengandung 23,3% unsur Co ; 25,3% Mo; dan 51,4% Cl. Tentukan rumus empiris senyawa tersebut
Soal No.19
Suatu senyawa mengandung 9,20% natrium; 12,8% belerang; dan 9,60% oksigen. Jika Ar Na = 23, S = 32, dan O = 16, tentukan rumus kimia dari senyawa tersebut
Soal No.20
Hidrokarbon (CxHy) yang volumenya 10 cm3 dibakar sempurna dengan 20 cm3 gas oksigen dan menghasilkan 10 cm3 gas karbon dioksida. Jika semua gas diukur pada suhu dan tekanan yang sama, tentukan rumus molekul senyawa tersebut.
PEMBAHASAN :
Soal No.21
Monosodium glutamat (MSG) adalah zat penyedap rasa yang lebih dikenal dengan nama vetsin. Senyawa dengan massa molar sekitar 169 g/mol tersebut mengandung 35,51 % karbon; 4,77% hidrogen; 37,85% oksigen; 8,29% nitrogen; dan 13,60% natrium. Tentukan rumus kimia senyawa tersebut
Soal No.22
Suatu senyawa karbon mengandung unsur C, H dan O. Pada pembakaran 9,2 gram senyawa tersebut, diperoleh 17,6 g CO2 dan 10,8 g H2O. Bila massa molekul relatif senyawa tersebut adalah 46, tentukan rumus molekulnya (Ar H = 1, C = 12, O = 16)
Soal No.23
Cuka perdagangan mengandung cuka 25%. Berapa mL air yang harus ditambahkan ke dalam 100 mL cuka tersebut agar kadarnya menjadi 5%?
PEMBAHASAN :
Menggunakan rumus:
%1. V1 = %2. V2
25.100 = 5.(100+x)
2500 = 500 + 5x
5x = 2000
x = 400 mL
Soal No.24
Di dalam udara bersih terdapat gas CO2 0,003%. Berapa kadar CO2 tersebut jika dihitung dalam bpj?
Soal No.25
Berapa gram perusi yang harus dilarutkan dalam 500 cm3 air agar diperoleh larutan perusi 2% (tidak terjadi perubahan volume)
Soal No.26
Berapa cm3 iodium yang terdapat di dalam 100 cm3 larutan iodium yang kadarnya 2,5%?
Soal No.27
Larutan alkohol dengan kadar 80% sebanyak 200 cm3 dicampur dengan 300 cm3 larutan alkohol yang kadarnya 40%. Tentukan kadar alkohol dalam campuran tersebut.
Soal No.28
Di dalam perairan yang tercemar, terdapat logam raksa dengan kadar 50 bpj. Berapa mg raksa yang terdapat dalam setiap 1 liter air?
Soal No.29
Berapa gram gula yang harus ditambahkan ke dalam 100 cm3 larutan gula 10% agar larutan gula tersebut kadarnya berubah menjadi 30%?
Soal No.30
Larutan NH3 2 M yang volumenya 100 mL diencerkan dengan air sampai volumenya 500 mL. Berapa molaritas larutan encer yang terjadi?
Soal No.31
Berapa gram kristal H2C2O4.2H2O yang harus dilarutkan ke dalam air agar didapatkan 600 mL larutan H2C2O4 0,5 M? (Ar C = 12, O = 16, H = 1)
Soal No.32
Di dalam 400 mL larutan terlarut 3,4 gram NH3 (Ar N = 14, H = 1). Hitunglah
- Molaritas larutan
- Fraksi mol larutan
Soal No.33
Hitunglah molalitas dan fraksi mol larutan NaOH dalam air yang kadarnya 40% (Mr NaOH = 40)
Soal No.34
Jika perubahan volume dalam pelarutan diabaikan, tentukan molaritas dan molalitas larutan yang terjadi bila 100 mL etanol dicampur dengan 200 mL air (dianggap massa jenis alkohol dan air sama dengan 1 gram/mL)
Soal No.35
Berapa gram KOH yang harus dilarutkan ke dalam 400 mL air air agar didapatkan larutan KOH 1 M? (Ar K = 39, O = 16, H = 1)
Soal No.36
Berapa cm3 HCl 12 M yang harus diambil untuk membuat larutan HCl 2M sebanyak 500 cm3
PEMBAHASAN :
Rumus pengenceran
M1. V1 =M2. V2
12.V1 = 2. 500
V1 = 1.000/12 = 83,34 cm3
Soal No.37
Larutan H2SO4 yang kadarnya 98% dan massa jenisnya 1,8 gram cm3 sebanyak 100 mL diencerkan hingga volume larutan menjadi 500 cm3. Berapa molaritasnya?
PEMBAHASAN :
Soal No.38
Tentukan fraksi mol urea dalam larutan urea 30% (Mr urea = 60)
Soal No.39
Tentukan molalitas dari 500 mL larutan yang mengandung 5% massa H2SO4 jika diketahui massa jenis larutan 1,2 g/mL
Soal No.40
Berapa gram urea (CO(NH2)2) harus dilarutkan dalam 150 mL air (massa jenis air = 1 g/mL) agar kemolalan sama dengan 0,5?
PEMBAHASAN :
Soal No.41
Berapakah kemolalan larutan glukosa yang mengandung 12% massa glukosa?(Mr glukosa = 180)
Soal No.42
Larutan asam klorida 18,25% mempunyai massa jenis 1,1 g/mL. Tentukan fraksi mol masing-masing zat dalam larutan tersebut.
Soal No.43
Pada pelarutan kalium klorat, menurut persamaan reaksi:
2KClO3 → 2KCl + 3O2
Telah terbentuk 696 mL gas oksigen. Bila gas ini diukur pada keadaan di mana 0,58 liter gas nitrogen massanya 0,7 gram, hitunglah banyaknya kalium klorat yang telah terurai (Ar K = 39; Cl = 35,5; O = 16; N =14)
Soal No.44
Besi yang massanya 28 gram direaksikan dengan asam klorida sampai semua besi habis bereaksi
Fe + 2HCl → FeCl2 + H2
Hitunglah volume gas hidrogen yang dihasilkan, diukur pada 27oC, 1 atm (Ar Fe = 56)
Soal No.45
Sejumlah logam seng direaksikan dengan larutan asam klorida sampai habis dengan reaksi:
Zn + 2HCl → ZnCl2 + H2
Jika gas hidrogen yang dihasilkan pada 0oC 1 atm adalah 2,24 liter, tentukan massa seng tersebut (Ar Zn = 65)
Soal No.46
Suatu cuplikan yang mengandung logam seng dengan massa 10 gram direaksikan dengan larutan asam klorida sampai semua sengnya habis bereaksi
Zn + 2HCl → ZnCl2 + H2
Jika gas hidrogen yang dihasilkan pada 0OC 1 atm adalah 1,12 liter, tentukan kadar seng di dalam cuplikan tersebut (Ar Zn = 65)
Soal No.47
Paduan logam Na dan Al yang massanya 3,75 gram tepat habis bereaksi dengan 200 mL larutan HCl 1 M dengan reaksi:
Na + HCl → NaCl + H2
Al + HCl → AlCl3 + H2
Bila Ar Na = 23 dan Al = 27, tentukanlah:
- Massa masing-masing logam dalam campuran,
- Volume gas H2 yang dihasilkan pada reaksi tersebut diukur pada keadaan standar
Soal No.48
Untuk menentukan air kristal natrium fosfat, sebanyak 38 gram kristal Na3PO4.xH2O dipanaskan hingga semua air kristalnya menguap. Ternyata setelah penguapan, massa kristal tinggal 16,4 gram. Ar Na = 23, P = 31, O = 16, dan H = 1, tentukan jumlah kristal dalam kristal natrium fosfat tersebut
Soal No.49
Kristal barium klorida yang massanya 1,22 gram dilarutkan ke dalam air, kemudian direaksikan dengan larutan natrium sulfat berlebih sesuai reaksi:
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
Setelah disaring, endapan yang dihasilkan dikeringkan dan ditimbang. Ternyata, massa endapannya adalah 1,165 gram. Jika Ar Ba = 137; Cl = 35,5; S = 32; O = 16; dan H = 1, tentukan jumlah air kristal di dalam kristal BaCl2 tersebut.
Soal No.50
Logam magnesium dengan massa 3 gram direaksikan dengan larutan asam klorida yang mengandung HCl 40 gram. Reaksi yang terjadi adalah:
Mg + HCl → MgCl2 + H2
Tentukan:
- Pereaksi pembatas
- Gas hidrogen yang dihasilkan, diukur pada 27oC, 1 atm
Soal No.51
Logam bismuth dapat dibuat dari reaksi bismuth(III) oksida dengan karbon sesuai reaksi:
Bi2O3 + C → Bi + CO
Bila direaksikan 50 gram Bi2O3 dan 100 gram karbon, tentukan:
- Pereaksi pembatasnya,
- Massa logam Bi yang dihasilkan (Ar Bi = 208, O = 16, dan C = 12)
PEMBAHASAN :
Soal No.52
Hitunglah massa Al(OH)3 yang dihasilkan bila 158 gram alumunium sulfida direaksikan dengan 131 gram air dengan persamaan reaksi:
Al2S3 + H2O → Al(OH)3 +H2S
Diketahui Ar Al =27, S = 32, H = 1, O = 16
Soal No.53
Sebanyak 16,8 gram kalsium nitrat dan 17,5 gram amonium fluorida direaksikan dalam ruang tertutup menghasilkan kalsium fluorida, dinitrogen monoksida, dan uap air. Hitunglah massa masing-masing zat yang dihasilkan.
Soal No.54
Mangan dioksida yang massanya 72,5 gram direaksikan dengan 58,6 gram asam klorida hingga membentuk mangan (II) klorida, gas klorin, dan uap air
- Tuliskan persamaan reaksinya
- Tentukan pereaksi pembatasnya
- Berapa massa mangan (II) klorida yang dihasilkan?
- Berapa liter volume gas klorin yang dihasilkan, diukur pada 27oC, 1 atm?
- Berapa volume uap air yang dihasilkan jika 2 liter gas nitrogen mempunyai massa 2,8 gram?
Soal No.55
Logam alumunium berlebihan direaksikan dengan 100 cm3 larutan asam sulfat 2 M dengan reaksi: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
- Berapa gram logam alumunium yang habis bereaksi dengan 100 mL larutan H2SO4 2 M tersebut
- Berapa liter gas hidrogen yang dapat dihasilkan dalam keadaan STP? (ArAl = 27)
Soal No.56
Gas karbondioksida yang volumenya 6,72 (STP) liter dialirkan ke dalam larutan Ba(OH)2. Jika gas CO2 habis bereaksi, berapa gram endapan yang dihasilkan? (Ar Ba = 137; C = 12; O = 16) Reaksi yang terjadi : Ba(OH)2 + CO2 → BaCO3 + H2O
Soal No.57
Logam seng direaksikan dengan asam klorida 2 M. Jika ternyata seng telah habis bereaksi sebanyak 13 gram tentukan berapa liter gas yang dihasilkan diukur pada saat 1 liter gas NO massanya 1 gram (Ar Zn = 65, N =14, O = 16)
Soal No.58
Ke dalam 200 cm3 larutan AgNO3 0,1 M ditambahkan 100 cm3 larutan NaCl 0,1 M. Jika diketahui Ar Ag = 108, dan Cl = 35,5 tentukan endapan maksimum yang dapat terjadi, jika reaksinya:
AgNO3 + NaCl → AgCl + NaNO3
Soal No.59
Magnesium hidroksida (Mg(OH)2)dikenal sebagai bubur magnesia yang dapat dibentuk dari reaksi antara larutan natrium hidroksida dengan larutan magnesium klorida:
NaOH + MgCl2 → Mg(OH)2 + NaCl
Berapa cm3 larutan natrium hidroksida 0,3 M yang diperlukan agar tepat bereaksi dengan 75 cm3 larutan magnesium klorida 0,2 M dan berapa gram magnesium hidroksida maksimum dapat dihasilkan? (Ar Mg = 24, O = 16 dan H = 1)
Sumber Soal : Kelas X Penerbit Erlangga Pengarang Unggul Sudarmo
Soal No.1 (SBMPTN 2018)
Gas disilana (Mr = 62) bereaksi dengan gas O2 (Mr = 32) pada suhu tertentu menurut reaksi berikut
2Si2H6(g) + 7O2(g) → 4SiO2(s) + 6H2O(l)
Massa SiO2 (Mr = 60) yang dihasilkan dari reaksi antara 46,5 g Si2H6 dan 128 g O2 adalah…
Pembahasan Dalam Bentuk Video:
Soal No.2 (SBMPTN 2018)
Reaksi pembakaran sempurna etanol berlangsung menurut reaksi berikut
C2H5OH(g) + 3O2(g) → 2CO2(g) + 3H2O(g)
Jika volume gas CO2 pada reaksi tersebut adalah 200 mL, volume total gas-gas hasil reaksi adalah….
- 200 mL
- 300 mL
- 400 mL
- 500 mL
- 600 mL
Menurut hukum Gay perbandingan volume akan sebanding dengan perbandingan koefisien. Jika diketahui volume CO2 yang dihasilkan sebanyak 200 mL maka volume H2O dapat diketahui melalui perbandingan dengan koefisien
Maka volume total dari hasil reaksi adalah = V CO2 + V H2O = 200 + 300 = 500 mL
Jawaban D
Pembahasan Dalam Bentuk Video:
Soal No.3 (SBMPTN 2017)
Perhatikan persamaan reaksi (belum setara) berkut.
M3O4(s) + CO(g) → MO(s) + CO2(g)
Jika 2,8 g CO (Ar O = 16; C = 12) bereaksi sempurna menghasilkan 21,6 g MO, Ar M adalah….
Kita setarakan terlebih dahulu reaksinya:
M3O4(s) + CO(g) → 3MO(s) + CO2(g) (sudah setara)
Menentukan mol CO untuk menentukan mol MO
Menentukan mol MO melalui perbandingan koefisien
Menentukan Mr MO dari mol MO
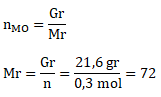
Menentukan Ar M dari Mr MO
Mr MO = Ar M x 1 + Ar O x 1
72 = Ar M + 16
Ar M = 72 – 16 = 56
Jawaban C
Pembahasan Dalam Bentuk Video:
Soal No.4 (SBMPTN 2017)
Sebanyak 10 mL H2C2O4 0,5 M direaksikan dengan 70 mL LiOH 0,2 M menurut reaksi (belum setara) berikut.
H2C2O4 (aq) + LiOH(aq) → Li2C2O4(aq) + H2O(l)
Konsentrasi LiOH setelah reaksi adalah….
- 0,010 M
- 0,025 M
- 0,050 M
- 0,100 M
- 0,500 M
Kita setarakan reaksinya
H2C2O4 (aq) + 2LiOH(aq) → Li2C2O4(aq) + 2H2O(l) (sudah setara)
Menentukan mol H2C2O4 dan LiOH
mol H2C2O4 = M x V = 0,5 M x 10 mL = 5 mmol
mol LiOH = M x V = 0,2 M x 70 mL = 14 mmol
Menentukan pereaksi pembatas
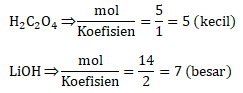
Karena H2C2O4 lebih kecil hasil pembagiannya maka H2C2O4 merupakan pereaksi pembatas

Maka konsentrasi LiOH setelah reaksi adalah
n LiOH = M x Vtotal (Volume total karena sudah dicampurkan)
4 mmol = M x (10 + 70)
Jawaban C
Pembahasan Dalam Bentuk Video:
Soal No.5 (SBMPTN 2017)
Sebuah tabung bervolume tetap berisi 6 g gas H2 (Ar H = 1) memiliki tekanan 12 atm pada temperatur tertentu. Ke dalam tabung tersebut ditambahkan gas Ne (Ar Ne = 20), sehingga tekanannya menjadi 40 atm tanpa mengubah temperatur. Massa gas total di dalam tabung tersebut adalah….
- 26 g
- 56 g
- 140 g
- 146 g
- 286 g
Diketahui:
Gr H2 = 6 g
Ar H = 1
P H2 = 12 atm
P setelah ditambah Ne = 40 atm
Ar Ne = 20
Karena dilakukan pada volume dan suhu yang tetap berlaku:
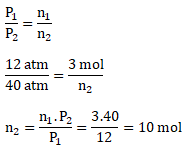
n2 merupakan mol total dari mol H2 dan mol Ne
n2 = nH2 + nNe
10 mol = 3 mol + nNe
n Ne = 10 – 3 = 7 mol
Menentukan massa Ne dari mol Ne
Gr Ne = n x Ar Ne = 7 mol x 20 = 140 gram
Jawaban C
Pembahasan Dalam Bentuk Video:
Soal No.6 (SBMPTN 2016)
Analisis terhadap suatu senyawa menghasilkan rumus empiris NaCO2 (Ar Na = 23, O = 16, dan C = 12). Jika 1 mol senyawa ini mempunyai massa 134 g dan bilangan Avogadro L = 6,02 x 1023, maka jumlah atom karbon dalam 0,1 mol senyawa ini adalah…
- 1,2 x 1023
- 6,02 x 1023
- 3,01 x 1023
- 3,01 x 1022
- 6,02 x 1020
Diketahui:
massa senyawa = 134 g
n = 0,1 mol
Maka Mr nya
Mr Rumus empiris (RE) NaCO2 = (23 x 1) + (12 x 1) + (16 x 2) = 67
Menentukan rumus molekul
(Mr RE)n = Mr Senyawa
(67)n = 134
n = 2
Maka rumus molekulnya (NaCO2)2 = Na2C2O4
Maka jumlah atom karbon dalam 0,1 mol zat tersebut adalah
Jumlah atom C di dalam Na2C2O4 = a x n x L = 2 x 0,1 x 6,02 x 1023 = 12,04 x 1023 = 1,204 x 1023
Jawaban A
Pembahasan Dalam Bentuk Video:
Soal No.7 (SBMPTN 2016)
Sebanyak 5,6 g B2H6 direaksikan dengan 42,6 g Cl2 sehingga terjadi reaksi berikut:
B2H6(g) +Cl2(g) → BCl3(g) + HCl(g) (belum setara)
Massa HCl (Ar B = 11, H = 1, Cl = 35,5) yang diperoleh dari reaksi tersebut adalah….
- 7,3 g
- 10,95 g
- 21,9 g
- 14,6 g
- 36,5 g
Kita setarakan persamaan reaksinya:
B2H6(g) + 6Cl2(g) → 2BCl3(g) + 6HCl(g) (sudah setara)
Menentukan mol B2H6 dan Cl2
Mr B2H6 = 11 x 2 + 1 x 6 = 28
Mr Cl2 = 35,5 x 2 = 71
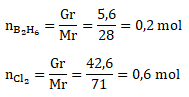
Menentukan pereaksi pembatas
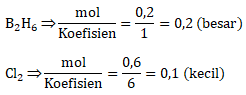
Karena Cl2 lebih kecil hasil pembagiannya maka Cl2 merupakan pereaksi pembatas

Maka massa HCl setelah reaksi adalah
n HCl = 0,6 mol
Gr HCl = n x Mr = 0,6 mol x 36,5 = 21,9 gram
Jawaban C
Pembahasan Dalam Bentuk Video:
Soal No.8 (SBMPTN 2016)
Padatan NH4NO3 (Ar N = 14, H = 1, O = 16) jika dipanaskan akan terurai menjadi gas N2 dan uap air menurut reaksi berikut:
NH4NO3(s) → N2O(g) + 2H2O(g)
Pemanasan 40 g padatan NH4NO3 menghasilkan 10 L gas N2O. Jika pada kondisi yang sama 10 L gas X memiliki massa 22 g, maka massa molekul relatif (Mr) gas X adalah….
Reaski sudah setara
NH4NO3(s) → N2O(g) + 2H2O(g)
Diketahui:
Gr NH4NO3 = 40 g
Mr NH4NO3 = 14 x 2 + 1 x 4 + 16 x 3 = 80
Menentukan mol NH4NO3
Menentukan mol N2O melalui perbandingan dengan mol NH4NO3
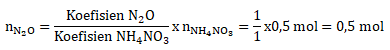
Menentukan Mr X menggunakan Hukum Avogadro
Karena pada P dan T yang sama berlaku:
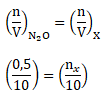
nx = 0,5 mol
Jawaban B
Pembahasan Dalam Bentuk Video:
Soal No.9 (SBMPTN 2015)
Sebanyak 7,8 g suatu senyawa organik X dibakar secara sempurna dengan oksigen berlebih menghasilkan 26,4 g CO2 (Ar C = 12, O = 16) dan 5,4 g H2O (Ar H = 1). Senyawa X yang mungkin adalah….
- asam propanoat
- n-butanal
- 2-pentunal
- benzena
- sikloheksadiena
Senyawa Organik mengandung unsur C, H dan O (CxHyOz), jika dibakar maka reaksinya
CxHyOz + O2 → CO2 + H2O
Menentukan massa O2 dari hukum kekekalan massa
massa CxHyOz + massa O2 = massa CO2 + massa H2O
massa O2 = (26,4 + 5,4) – 7,8 = 24 gr
Menentukan mol CO2 dan H2O

Perbandingan mol = perbandingan koefisien = mol CO2 : mol H2O : mol O2= 0,6 : 0,3 : 0,75 = 4 : 2 : 5, maka koefisiennya
CxHyOz + 5O2 → 4CO2 + 2H2O
Menentukan rumus empiris dari penyetaraan reaksi
x = 4 (jumlah atom C)
y = 4 (jumlah atom H)
z = 0 (jumlah atom O)
Maka rumus empirisnya adalah
C4H4 atau CH
yang memenuhi adalah C6H6 atau benzena
Jawaban D
Pembahasan Dalam Bentuk Video:
Soal No.10 (SBMPTN 2018)
Persentase massa atom Cl (Ar = 35,5) dalam suatu senyawa organik adalah 35,5%. Jika tetapan Avogadro = 6,0 x 1023, jumlah atom Cl yang terdapat dalam 0,9 g senyawa tersebut adalah….
- 6,7 x 1025
- 6,0 x 1023
- 0,9 x 1022
- 5,4 x 1021
- 3,0 x 1021
Pembahasan Dalam Bentuk Video:
Soal No.11 (SBMPTN 2015)
Silikon karbida atau karborundum dapat diperoleh dengan mereaksikan SiO2 (Ar Si = 28, O = 16) dengan karbon (Ar C = 12) pada temperatur tinggi, menurut reaksi:
2C(s) + SiO2(s) → SiC(s) + CO2(g)
Jika 4,5 g karbon direaksikan dengan 3,0 g SiO2 menghasilkan 1,5 g karborundum, maka persentase hasil reaksi tersebut adalah….
Diketahui:
Gr karbon = 4,5 gram
Gr SiO2 = 3 gram
Reaksi sudah setara
2C(s) + SiO2(s) → SiC(s) + CO2(g)
Menentukan mol B2H6 dan Cl2
Ar C = 12
Mr SiO2 = 28 x 1 + 16 x 2 = 60
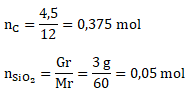
Menentukan pereaksi pembatas
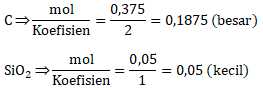
Karena SiO2 lebih kecil hasil pembagiannya maka SiO2 merupakan pereaksi pembatas

Maka massa karborundum yang dihasilkan dari perhitungan reaksi adalah
n SiC = 0,05 mol
Gr SiC = n x Mr = 0,05 mol x 40 = 2 gram
Maka persentase yang dihasilkan adalah
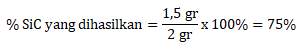
Jawaban D
Pembahasan Dalam Bentuk Video:
Soal No.12 (SBMPTN 2015)
Sebanyak 50,0 g bijih yang mengandung Mn, dilarutkan dalam asam nitrat pekat berlebih. Semua ion Mn2+ diendapkan sebagai padatan MnS (Ar Mn = 55; S = 32). Bila diperoleh 43,5 g endapan, maka kadar Mn dalam bijih tersebut adalah….
Diketahui:
Gr bijih = 50 gram
Menentukan massa Mn dari MnS
maka kadar Mn dalam bijih adalah
Jawaban C
Pembahasan Dalam Bentuk Video:
Ok demikian rangkuman materi dan contoh soal konsep mol & stoikiometri berikut video pembelajaran. Kalau ada yang kurang paham bisa kamu tanya di kolom komentar yah, semoga materi ini berguna buat kalian. Kalau bermanfaat bantu kita juga yah untuk share dan beritahu teman kamu untuk berkunjung kesini. Terima kasih.
Semoga Bermanfaat