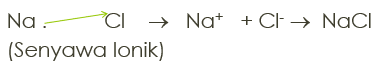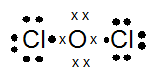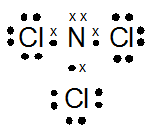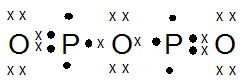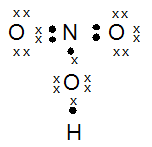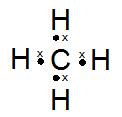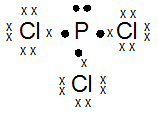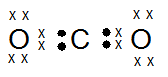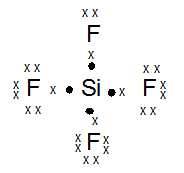Untuk Pembelajaran selanjutnya…
Unsur berdasarkan kestabilan:
- Unsur Stabil (Tidak perlu berikatan)
Golongan VIIIA : He, Ne, Ar, Kr, Xe, Rn
2He : 1s2, e.v = 2
10Ne : 1s2 2s2 2p6 , e.v = 8
18Ar : 1s2 2s2 2p6 3s2 3p6 e.v = 8
36Kr : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6, e. v = 8
- Unsur Tidak Stabil (harus berikatan) agar stabil maka konfigurasinya harus sama dengan konfigurasi gas mulia
Kaidah Duplet
Kaidah duplet : supaya stabil maka elektron valensi di kulit pertama harus = 2 (mengikuti Helium He)
6He : 1s2, e.v = 2 (kaidah duplet)
Pengikut: 1H, 3Li, 4Be, 5B
Kaidah Oktet
Kaidah Oktet : supaya stabil maka elektron valensi nya harus = 8.
Pengikut: unsur selain pengikut duplet
Supaya stabil unsur dapat menerima atau melepas elektron
Contoh:
- 1H : 1s1 (menerima 1e—)
1H— : 1s2 (Stabil) - 3Li : 1s2 2s1, e.v = 1 (melepas 1e—)
3Li+ : 1s2 (stabil) - 15P : 1s2 2s2 2p6 3s2 3p3 e.v = 5 (menerima 3e—)
. 2 8 5
15P3- : 1s2 2s2 2p6 3s2 3p6 Stabil
. 2 8 8 - 20Mg : 1s2 2s2 2p6 3s2 3p6 4s2 , e.v = 2 (melepas 2e—)
. 2 8 8 2
20Mg2+ : 1s2 2s2 2p6 3s2 3p6 (Stabil)
. 2 8 8
Aturan penangkapan atau pelepasan elektron di Oktet :
- Jika e. V kurang dari 4 maka agar stabil harus melepas e- menjadi ion positif.
- Jika e.v = 4, unsur-unsurnya yaitu:
6C, 14Si, 32Ge (menerima 4e—)
50Sn, 82Pb (melepas 4e—)
- Jika e. V lebih dari 4 maka agar stabil akan menerima e— menjadi ion negatif.
Ikatan Ionik
Ikatan yang terjadi oleh Logam (melepas e) dengan non logam (menewak e). Terjadi akibat serah terima elektron. Contoh:
11Na dengan 17Cl
11Na : 1s2 2s2 2p6 3s1 (melepas 1e)
17Cl : 1s2 2s2 2p6 3s2 3p5 (menerima 1e)
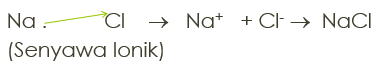
Contoh Lain
12Mg dengan 9F
12Mg : 1s2 2s2 2p6 3s2, e.v = 2 (melepes 2e) x 1
9F : 1s2 2s2 2p5 , e.v = 7 (menerima 1e) x 2
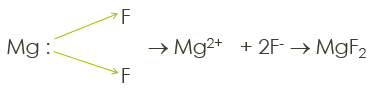
Ikatan Kovalen
Ikatan yang terjadi oleh non logam (menerima e) dengan non logam (menerima e). Terjadi akibat pemakaian elektron bersama.
Kovalen Polar dan Non Polar
- Kovalen Polar (Memiliki Kutub)
Ciri-cirinya:- Jika jumlah atomnya = 2, unsurnya berbeda (keelektronegatifan berbeda), contoh: HCl, HBr, HF
- Jika jumlah atomnya lebih dari 2, keelektronegatifannya berbeda atau memiliki PEB, Contoh : H2O, PCl3
- Kovalen Non Polar (Tidak Memiliki Kutub)
Ciri-cirinya:- Jika jumlah atomnya = 2, unsurnya sama (keelektronegatifan sama), contoh: Cl2, O2, N2
- Jika jumlah atomnya lebih dari 2, tidak memiliki PEB, Contoh : CCl4, CH4.
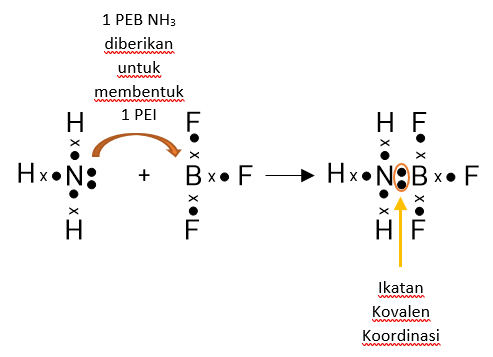
Kovalen Koordinasi
Yaitu kovalen yang pasangan elektron ikatanana berasal dari salah satu atom.
Perbedaan Senyawa Ion dan Kovalen
|
Perbedaan |
Seny. Ion | Seny. Kov. Polar | Seny. Kov.
Non Polar |
|
Titik didih/Titik Leleh |
Tinggi | Sedang |
Rendah |
|
Daya Hantar Listrik |
s : Tidak
l : Menghantar Aq:Menghantar |
s : Tidak
l : Tidak Aq:Menghantar |
s : Tidak l : Tidak Aq:Tidak |
| Kelarutan dalam air | Larut | Umumnya larut |
Tidak larut |
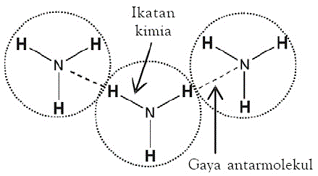
Gaya Antar Molekul
Perbedaan Ikatan intra dan antar
- Ikatan intra terjadi dalam satu molekul, contohnya ikatan ionik dan kovalen
- Ikatan Antar Molekul terjadi antara 2 molekul atau lebih
Jenis Ikatan
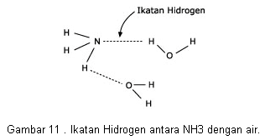
Ikatan Hidrogen
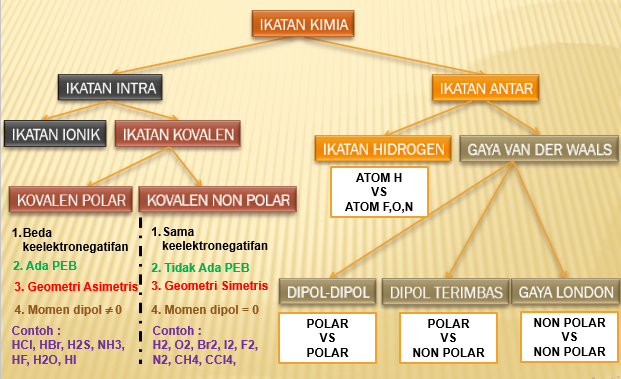
Terjadi antara atom H (sangat elektropositif/sangat ingin melepas elektron) dengan atom F, O, N (sangat elektronegatif/sangat ingin menangkap elektron)
Ikatan antar molekul ini paling kuat di antara ikatan antar molekul lainnya
Dipol-dipol
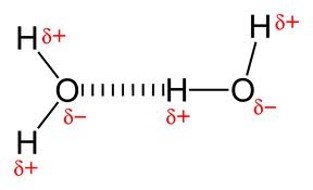
Terjadi antara molekul polar dengan molekul polar.
Di dalam molekul polar terdapat kutub(dipol) positif dan negatif. Positif & negatif akan terjadi tarik menarik (ikatan)

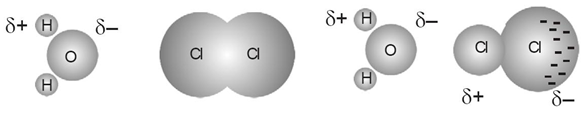
Dipol terimbas
Terjadi antara molekul polar dengan molekul non polar.
Di dalam molekul polar terdapat kutub(dipol) positif dan negatif. Pada molekul non tidak terdapat kutub, tetapi akan terpengaruhi oleh kutub dari molekul polar.
Gaya London
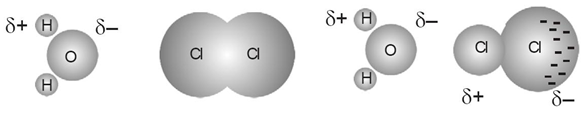
Terjadi antara molekul non polar dengan molekul non polar.
Di dalam molekul nonpolar tidak terdapat kutub(dipol) positif dan negatif. Akan memiliki kutub akibat perpindahan elektron yang sementara.
Ikatan Ini paling lemah
Hubungan titik didih dengan ikatan
Semakin kuat ikatan semakin besar titik didih, karena semakin sulit memutuskan ikatan
Urutan kekuatan ikatan:
Ikatan Hidrogen > Dipol-Dipol > Dipol Terimbas > Gaya London
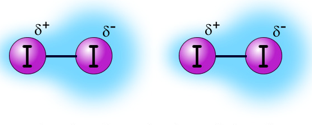
Jika ikatan antar molekulnya sama (gaya london), maka kekuatan ikatan ditentukan dari Mr, Semakin besar Mr semakin kuat ikatannya
Contoh:
I2, Mr = 127 x 2 = 254 dengan
Cl2, Mr = 35,5 x 2 = 71
Maka lebih kuat I2 dibanding Cl2
Videonya ada 2 part ya. Kalau terlalu kecil tekan opsi full screen di pojok kanan video. Silahkan menyimak!
- Ikatan Kimia
- Ikatan Antar Molekul
Soal No.1
Bagaimana kecenderungan atom-atom berikut ini dalam mencapai kestabilan, jika ditinjau dari konfigurasi elektronnya?
PEMBAHASAN :
- 6C : 2 4 (menangkap 4e)
- 9F : 2 7 (menangkap 1e)
- 19K : 2 8 1 (melepas 1e)
- 20Ca : 2 8 8 2 (melepas 2e)
- 16S : 2 8 6 (menangkap 2e)
- 13Al : 2 8 3 (melepas 3e)
Soal No.2
Jelaskan pengertian ikatan ion
PEMBAHASAN :
Ikatan yang terjadi karena adanya gaya tarik-menarik elektrostatis antara ion postif dengan ion negatif. Atau ikatan yang terjadi antara logam (melepas elektron) dengan non logam (menangkap elektron)
Soal No.3
Unsur-unsur logam bila bersenyawa dengan unsur-unsur non logam mempunyai kecenderungan untuk membentuk ikatan ion. Bagaimana pendapat Anda tentang pernyataan ini? Jelaskan
PEMBAHASAN :
Unsur logam untuk mencapai kestabilan akan melepaskan elektron valensinya membentuk ion positif sedangkan unsur non logam mencapai kestabilan dengan menangkap elektron membentuk ion negatif. Ion positif dan ion negatif akan terjadi gaya tarik menarik elektrostatik yang kemudian disebut ikatan ion
Soal No.4
Jelaskan terjadinya ikatan ion pada senyawa berikut:
- K2S (nomor atom K = 19 dan S = 16)
- MgF2 (nomor atom Mg = 12 dan F = 9)
PEMBAHASAN :
- 19K : 2 8 8 1 (melepas 1e)
K → K+ + e (karena S menangkap 2e maka jumlah atom K harus 2)
16S : 2 8 6 (menangkap 2e)
S + 2e— → S2-
2K+ + S2- → K2S - 12Mg : 2 8 2 (melepas 2e)
Mg → Mg2+ + 2e
9F : 2 7 (menangkap 1e)
F + e— → F— (karena Mg melepas 2e maka jumlah atom F harus 2)
Mg2+ + 2F— → MgF2
LIHAT JUGA : Video Pembelajaran Ikatan Kimia
Soal No.5
Mengapa kristal senyawa ion dapat pecah jika dikenai tekanan (dipukul)?
PEMBAHASAN :
Apabila senyawa ion dipukul, akan terjadi pergeseran posisi ion positif dan negatif, dari yang semula berselang-seling menjadi berhadapan langsung. Hal ini menyebabkan ion positif bertemu muka dengan ion positif dan terjadi gaya tolak-menolak. Hal ini yang menyebabkan senyawa ion bersifat rapuh.
Soal No.6
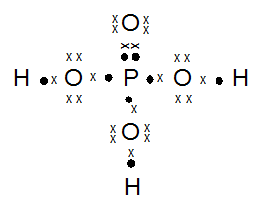
Gambarkan rumus titik elektron (struktur Lewis) dari molekul-molekul di bawah ini:
- Cl2O
- NCl3
- P2O3
- H3PO4
- HNO3
- CH4
- PCl3
- CO2
- SiF4
PEMBAHASAN :
Soal No.7
Atom S (nomor atom 16) bergabung dengan atom Cl (nomor atom 17) membentuk molekul SCl2
- Gambarkan rumus titik elektron dari molekul SCl2
- Tentukan berapa jumlah pasangan elektron ikatan dan elektron bebas di sekitar atom pusat (S).
PEMBAHASAN :
- 16S : 2 8 6 (menangkap 2e)
17Cl : 2 8 7 (menangkap 1e)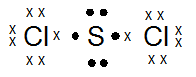
- Jumlah Pasangan elektron ikatan = 2
Pasangan elektron bebas = 2
Soal No.8
Atom 6C dan 1H dapat membentuk molekul C2H2, C2H4, dan C2H6
- Gambarkan rumus titik elektron untuk ketiga molekul tersebut
- Di antara ketiga molekul tersebut, molekul mana saja yang mempunyai ikatan tunggal, ikatan rangkap dua, dan ikatan rangkap tiga?
PEMBAHASAN :
- 6C : 2 4 (menangkap 4e)
1H : 1 (menangkap 1e)
C2H2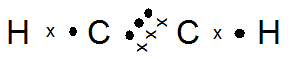 C2H4
C2H4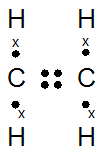 C2H6
C2H6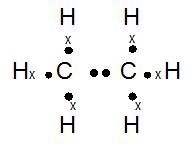
- Yang memiliki ikatan tunggal : C2H6
Ikatan rangkap 2 : C2H4
Ikatan rangkap 3 : C2H2
Soal No.9
Jelaskan terjadinya ikatan pada molekul PCl3 dengan menggunakan struktur Lewis dan tentukan jumlah pasangan elektron ikatan dan pasangan elektron bebasnya.
PEMBAHASAN :
15P : 2 8 5 (menangkap 3e)
17Cl : 2 8 7 (menangkap 1e)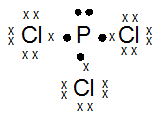
Jumlah pasangan elektron ikatan : 3
Jumlah Pasangan elektron bebas : 1
Soal No.10
Ikatan apa saja yang terdapat dalam senyawa KClO3?
PEMBAHASAN :
Terjadi ikatan ionik antara K+ dan ClO3— dan terjadi ikatan kovalen didalam ion ClO3—
Soal No.11
Jelaskan dengan singkat mengapa logam dapat menghantar listrik dengan baik
PEMBAHASAN :
Adanya elektron yang dapat bergerak bebas dari satu atom ke atom yang lain.
Soal No.12
Mengapa logam bersifat ulet, mudah ditempa, dan mudah dibuat menjadi kawat?
PEMBAHASAN :
Lautan elektron pada kristal logam memegang erat ion-ion pada logam sehingga bila dipukul atau ditempa, logam tidak akan pecah atau tercerai berai, tetapi akan bergeser.
Soal No.13
Kristal senyawa ion yang dikenai tekanan (dipukul) akan pecah sedangkan kristal logam tidak, jelaskan mengapa hal tersebut dapat terjadi.
PEMBAHASAN :
Apabila senyawa ion dipukul, akan terjadi pergeseran posisi ion positif dan negatif, dari yang semula berselang-seling menjadi berhadapan langsung. Hal ini menyebabkan ion positif bertemu muka dengan ion positif dan terjadi gaya tolak-menolak. Hal ini yang menyebabkan senyawa ion bersifat rapuh. Sedangkan dalam logam terjadi karena lautan elektron pada kristal logam memegang erat ion-ion pada logam sehingga bila dipukul atau ditempa, logam tidak akan pecah atau tercerai berai, tetapi akan bergeser.
Soal No.14
Di antara molekul-molekul berikut ini, manakah yang ikatannya polar dan yang ikatannya non-polar?
PEMBAHASAN :
- Non polar
- Non polar
- Non polar
- Polar
Soal No.15
Ramalkan bentuk molekul dari:
- SF6 (nomor atom S = 16)
- SiCl4 (nomor atom Si = 14)
- H2S (nomor atom S = 16)
- PCl5 (nomor atom P = 15)
PEMBAHASAN :
- 16S : 2 8 6 (e.v = 6)
A = 1 (Jumlah atom pusat)
B = 6 (Jumlah atom F/ PEI)
Sehingga termasuk kelompok molekul AB6 (Oktahedral) - 14Si : 2 8 4 (e.v = 4)
A = 1 (Jumlah atom pusat)
B = 4 (Jumlah atom Cl/ PEI)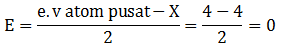
Sehingga termasuk kelompok molekul AB4 (Tetrahedral) - 16S : 2 8 6 (e.v = 6)
A = 1 (Jumlah atom pusat)
B = 2 (Jumlah atom H/ PEI)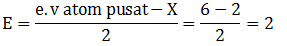
Sehingga termasuk kelompok molekul AB2E2 (Bengkok) - 15P : 2 8 5 (e.v = 5)
A = 1 (Jumlah atom pusat)
B = 5 (Jumlah atom Cl/ PEI)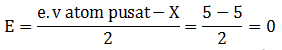
Sehingga termasuk kelompok molekul AB5 (Segitiga Bipiramida)
Soal No.16
Berdasarkan harga keelektronegatifan dan bentuk molekulnya, tentukan apakah molekul-molekul berikut bersifat
PEMBAHASAN :
- Non polar karena bentuk molekulnya simetris (tidak ada PEB)
- Non polar karena bentuk molekulnya simetris (tidak ada PEB)
- Non polar karena bentuk molekulnya simetris (tidak ada PEB)
- Non polar karena bentuk molekulnya simetris (tidak ada PEB)
Soal No.17
Apa yang dimaksud dengan gaya van der Waals?
PEMBAHASAN :
Gaya antar molekul yang terjadi pada antar molekul kovalen yang bekerja untuk mengikat molekul-molekul tersebut dalam satu kesatuan
Soal No.18
Hal apa saja yang menunjukkan adanya gaya antar-molekul? Jelaskan.
PEMBAHASAN :
Titik didih dan titik lebur. Jika gaya antar molekulnya kuat maka titik didih/titik leburnya akan tinggi begitu pula sebaliknya
Soal No.19
Mengapa suatu gas bila diturunkan suhunya pada suatu saat akan mencair dan akhirnya memadat? Jelaskan.
PEMBAHASAN :
Jika diturunkan suhunya maka jarak antar molekul menjadi sangat dekat. Akibatnya, gaya antar molekul menjadi sangat kuat sehingga dapat menyebabkan molekul-molekul gas berubah menjadi zat cair dan menjadi zat padat jika terus didinginkan
Soal No.20
Jelaskan manakah yang titik didih dan titik leburnya lebih tinggi: etanol (C2H5OH) atau dimetil eter (CH3 – O – CH3)? Jelaskan alasannya
PEMBAHASAN :
Pada etanol terdapat ikatan antar molekul yaitu ikatan hidrogen yang sangat kuat dibandingkan pada dimetil eter terjadi gaya antar molekul gaya van der Waals yang lebih lemah dibanding ikatan Hidrogen sehingga etanol akan memiliki titik didih yang lebih tinggi dibanding dimetil eter
Soal No.21
Faktor apa saja yang berpengaruh terhadap kekuatan gaya van der Waals?
PEMBAHASAN :
- Ukuran molekul
Semakin besar ukuran molekul semakin besar Mr sehingga titik didih dan titik leburnya makin tinggi - Bentuk molekul
Semakin dekat jarak antar molekul semakin kuat gaya antar molekulnya sehingga titik didih dan titik leburnya makin besar
Soal No.22
Apa yang dimaksud gaya dispersi dan apa penyebabnya? Jelaskan.
PEMBAHASAN :
Gaya tarik antar molekul yang terjadi antar molekul non polar. Timbul karena adanya dipol sesaat atau sementara
Soal No.23
Mengapa pada senyawa hidrokarbon berlaku jika rantai karbonnya makin panjang titik didihnya makin tinggi? Jelaskan.
PEMBAHASAN :
Semakin panjang rantai karbonnya semakin banyak tempat molekul tersebut saling tarik menarik sehingga ikatannya makin kuat yang menyebabkan titik didihnya makin tinggi
Sumber Soal : Kelas X Penerbit Erlangga Pengarang Unggul Sudarmo
Semoga Bermanfaat