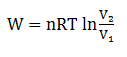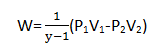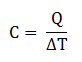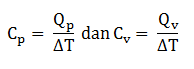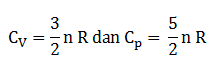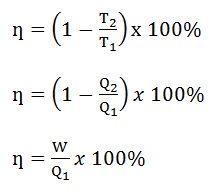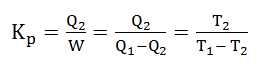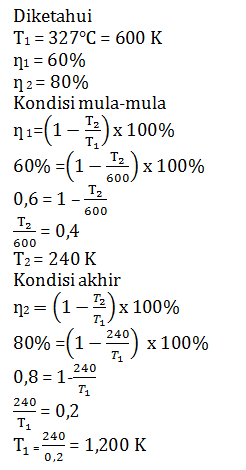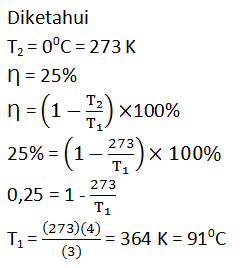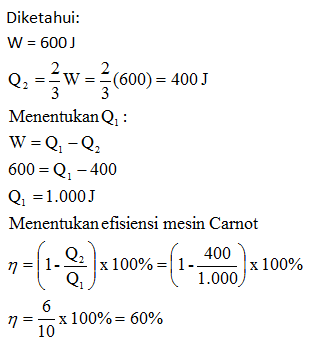Untuk Pembelajaran selanjutnya…
Termodinamika
Merupakan cabang ilmu fisika yang membahas hubungan panas/kalor dan usaha yang dilakukan oleh panas/kalor tersebut
Usaha sistem terhadap lingkungan
Persamaan usaha yang dilakukan gas dapat ditulis sebagai berikut:
W = p ∆V = p (V2 – V1)
Keterangan :
p = tekanan gas (N/m2)
∆V = perubahan volume (m3)
W = usaha yang dilakukan gas (joule)
Perubahan energi dalam
Perubahan energi dalam ∆U tidak bergantung pada proses bagaimana keadaan sistem berubah, tetapi hanya bergantung pada keadaan awal dan keadaan akhir sistem tersebut.
Hukum termodinamika
Hukum I Termodinamika
Hukum I termodinamika menyatakan bahwa jumlah kalor pada suatu sistem sama dengan perubahan energi dalam sistem ditambah usaha yang dilakukan oleh sistem
Q = ∆U + W
Perjanjian tanda untuk Q dan W sebagai berikut :
- Jika sistem melakukan usaha terhadap lingkungan maka W bertanda positif.
- Jika sistem menerima usaha dari lingkungan maka W bertanda negatif.
- Q bertanda positif jika sistem menerima kalor dari lingkungan
- Q bertanda negatif jika sistem memberikan kalor kepada lingkungan
Proses Termodinamika
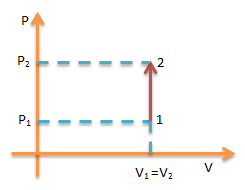
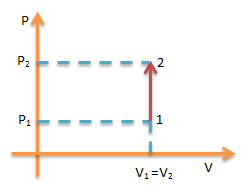
Proses Isokhorik
yaitu proses termodinamika yang terjadi pada gas dalam keadaan volum tetap.
Berlaku:
Usaha W= 0 maka Q = ΔU sehingga Q = 3/2 nRT (T2-T1)
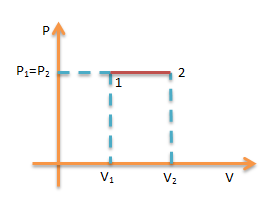
Proses Isobarik
yaitu proses termodinamika yang terjadi pada gas keadaan tekanan tetap.
berlaku persamaan.
Usaha W
W=P(V2 – V1)
Perubahan energi dalam ΔU
ΔU= 3/2 P(V2 -V1)
Sehingga
Q= 5/2 P(V2-V1)
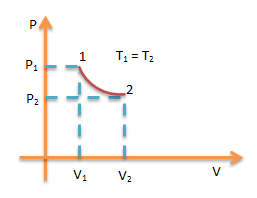
Proses Isotermik
merupakan proses termodinamika yang terjadi pada gas keadaan suhu tetap.
berlaku persamaan.
Usaha W
Perubahan energi dalam ΔU = 0 maka kalor Q = W
Proses Adiabatik
merupakan proses termodinamika yang berlangsung tanpa adanya pertukaran kalor antara sistem dan lingkungan.
berlaku persamaan.
Usaha W
Karena Q = 0 sehingga
ΔU = -W
y = konstanta Laplace
Kapasitas Kalor
Merupakan banyaknya kalor yang dibutuhkan untuk menaikan suhu gas sebesar 1oC, dinyatakan dengan persamaan:
Kapasitas kalor gas dapat dibedakan menjadi dua yaitu kapasitas kalor pada tekanan tetap (Cp) dan pada volume tetap (Cv)
Pada proses isokhorik
Qv = ∆U
Pada proses isobarik
Qp = ∆U + p∆V
Diperoleh:
Mesin Carnot dan Mesin Pendingin
Mesin Carnot
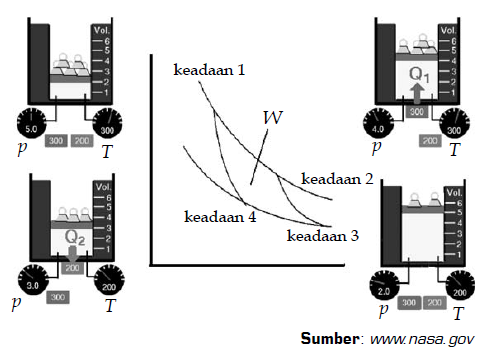
Sebuah mesin Carnot memiliki empat langkah dalam pengoprasiannya. Berikut urutan keempat langkah proses yang terjadi dalam siklus Carnot.
- Pada langkah pertama, gas mengalami ekspansi isotermal. Reservoir suhu tinggi menyentuh dasar silinder dan jumlah beban di atas piston dikurangi. Selama proses ini berlangsung, temperatur sistem tidak berubah, namun volume sistem bertambah. Dari keadaan 1 ke keadaan 2, sejumlah kalor (Q1) dipindahkan dari reservoir suhu tinggi ke dalam gas.
- Pada langkah kedua, gas berubah dari keadaan 2 ke keadaan 3 dan mengalami proses ekspansi adiabatik. Selama proses ini berlangsung, tidak ada kalor yang keluar atau masuk ke dalam sistem. Tekanan gas diturunkan dengan cara mengurangi beban yang ada di atas piston. Akibatnya, temperatur sistem akan turun dan volumenya bertambah.
- Pada langkah ketiga, keadaan gas berubah dari keadaan 3 ke keadaan 4 melalui proses kompresi isotermal. Pada langkah ini, reservoir suhu rendah (200 K) menyentuh dasar silinder dan jumlah beban di atas piston bertambah. Akibatnya tekanan sistem meningkat, temperaturnya konstan, dan volume sistem menurun. Dari keadaan 3 ke keadaan 4, sejumlah kalor (Q2) dipindahkan dari gas ke reservoir suhu rendah untuk menjaga temperatur sistem agar tidak berubah.
- Pada langkah keempat, gas mengalami proses kompresi adiabatik dan keadaannya berubah dari keadaan 4 ke keadaan1. Jumlah beban di atas piston bertambah. Selama proses ini berlangsung, tidak ada kalor yang keluar atau masuk ke dalam sistem, tekanan sistem meningkat, dan volumenya berkurang.
Mesin Carnot adalah mesin efisien yang bekerja dalam suhu reservoir tinggi dan suhu reservoir rendah. Oleh karena itu, suatu mesin Carnot memiliki efisiensi. Rumus efisiensi mesin Carnot sebagai berikut.
keterangan:
ŋ = efisiensi mesin kalor
T2 = suhu pada reservoir rendah (K)
T1 = suhu pada reservior tinggi (K)
W = usaha (Joule)
Q1= kalor yang diserap (Joule)
Q2 = kalor yang dilepas (Joule)
Mesin Pendingin
Prinsip kerja mesin pendingin contohnya lemari es dan penyejuk ruangan yaitu mengalirkan kalor keluar dari lingkungan sejuk ke lingkungan hangat. Sistem menerima kerja sebesar W dan menyerap kalor dengan suhu reservoir rendah T2 sebesar Q2 serta membuang sejumlah kalor yang lebih besar ke reservoir suhu tinggi T1 sebesar Q1. Untuk kerja dari mesin pendingin dapat ditentukan melalui koefisiensi performansi Kp.
Keterangan :
Kp = koefisiensi performansi
T2 = suhu pada reservoir rendah (K)
T1 = suhu pada reservior tinggi (K)
W = usaha (Joule)
Q1= kalor yang diserap (Joule)
Q2 = kalor yang dilepas (Joule)
Soal No.1 (SBMPTN 2017)
Suatu mesin dalam satu siklus menyerap kalor sebesar 2 x 103 Joule dari reservoir panas dan melepaskan kalor 1,5 103 Joule ke reservoir yang temperaturnya lebih rendah. Jika waktu yang diperlukan untuk melakukan 4 siklus adalah 2 detik. Maka daya tersebut sebesar
- 101 watt
- 102 watt
- 103 watt
- 104 watt
- 105 watt
PEMBAHASAN :
Diketahui:
4 siklus = 2 detik,
maka 1 siklus = 0,5 detik
Q1 = 2000 J
Q2 = 1500 J
W = 2000 – 1500
W = 500 J
P = W/t
P = 500/0,5
P = 1000 watt = 103 watt
Jawaban : C
Soal No.2 (UN 2014)
Sebuah mesin Carnot menggunakan reservoir suhu tinggi 327 oC, mempunyai efisiensi 60%. Agar efisiensi mesin Carnot naik menjadi 80% dengan suhu rendahnya tetap maka suhu tinggi mesin Carnot harus diubah menjadi…
- 300 K
- 450 K
- 480 K
- 1.200 K
- 1.800 K
Soal No.3 (SBMPTN 2014)
Sebuah mesin kalor memerlukan kerja 400 joule dalam siklusnya memiliki efisiensi 25% . Energi yang di ambil oleh reservoir panas adalah …
- 1.200 Joule
- 1.300 Joule
- 1.400 Joule
- 1.500 Joule
- 1.600 Joule
Soal No.4 (SNMPTN 2012)
Sebuah sistem 1 mol gas ideal monoatomik (Cp = 5/2 R) mengalami ekspansi isobarik pada tekanan 105 pa sehingga volumenya menjadi 2 kali volume awal. Bila volume awal 25 liter maka kalor yang diserap gas pada proses ini adalah …
- 2550 J
- 3760 J
- 4750 J
- 5730 J
- 6250 J
Soal No.5 (UN 2013)
Grafik P –V dari sebuah siklus Carnot terlihat seperti gambar berikut.
Jika kalor yang dilepas ke lingkungan 3.000 Joule maka kalor yang diserap sistem adalah…
- 3.000 J
- 4.000 J
- 4.800 J
- 6.000 J
- 8.000 J
Soal No.6 (SNMPTN 2009)
Satu mol gas ideal mengalami proses isotermal pada suhu T sehingga volumenya menjadi dua kali, jika R adalah konstanta gas molar, usaha yang dikerjakan oleh gas selama proses tersebut adalah ….
- RTV
- RT lnV
- 2RT
- RT ln 2
- RT ln (2V)
Soal No.7 (SNMPTN 2010)
Sebuah mesin carnot menyerap panas dari tandon panas bertemperatur 127°C dan membuang sebagian panasnya ke tandon dingin bertemperatur 27°C efisiensi terbesar yang dapat dicapai oleh mesin carnot tersebut adalah …..
- 20,5 %
- 25 %
- 70,25 %
- 90,7 %
- 100 %
Soal No.8 (SNMPTN 2010)
Jika sebuah mesin yang memiliki efisiensi terbesar 25% dalam operasinya membuang sebagian kalor ke tandon dingin yang bertemperatur 0C maka tandon panasnya bertemperatur …..
- 76 C
- 91 C
- 170 C
- 100 C
- 364 C
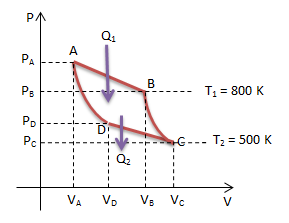
Soal No.9 (UN 2013)
Gambar di bawah menunjukan grafik p – V pada mesin Carnot.
Jika Q2 = 2/3 W maka efisiensi mesin carnot tersebut adalah…
- 40%
- 50%
- 60%
- 67%
- 75%
Soal No.10 (SPMB 2006)
2m3 gas helium bersuhu 27C di panaskan secra isobarik sampai 77C jika tekanannya 3x 105 N /M2 maka usaha yang di lakukan gas adalah ……
- 100 kJ
- 140 kJ
- 200 kJ
- 260 kJ
- 320 kJ
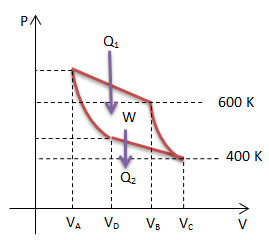
Soal No.11 (UN 2013)
Pada grafik p-V mesin Carnot berikut diketahui reservoir suhu tinggi 600 K dan suhu rendah 400 K.
Jika usaha yang di lakukan mesin adalah W maka kalor yang di keluarkan pada suhu rendah adalah…
- W
- 2W
- 3W
- 4W
- 6W
Soal No.12 (SPMB 2003)
Gas ideal yang melakukan pengembangan volume secara isobaris tidak melakukan usaha.
SEBAB
Usaha yang dilakukan oleh gas idel ketika mengembang sebanding dengan perubahan tekanan gas.
PEMBAHASAN :
Pernyataan I : Gas idel yang volumenya mengembang akan melakukan usaha dengan persamaan W = P∆V
Pernyataan II : Usaha yang di lakukan gas tidak sebanding dengan perubahan tekanan tetapi hanya sebanding dengan tekanan.
Jawaban : E
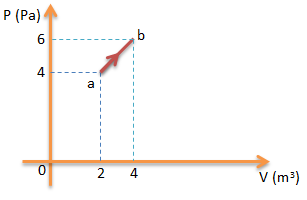
Soal No.13 (UN 2012)
Perhatikan gambar!
Gas ideal melakukan proses perubahan tekanan (P) terhadap volume (V), usaha yang dilakukan oleh gas pada proses tersebut adalah…
- 20 Joule
- 15 Joule
- 10 Joule
- 5 Joule
- 4 Joule
Soal No.14 (UMPTN 2010)
mesin carnot dioperasikan antara 2 reservoir kalor masing masing suhunya T1 dan T2 dengan T2 > T1. Efesiensi mesin tersebut 40% dan besarnya T1 =27 C. Supaya efisiennya naik 60% maka besarnya perubahan T1 adalah …
- 250 K
- 300 K
- 350 K
- 400 K
- 500 K
Soal No.15 (UMPTN 2001)
sebuah mesin carnot bekerja diantara dua reservoir bersuhu 527C dan 127C apabila reservoir suhu tinggi diturunkan menjadi 227C maka efesiensi mula mula dan terakhir masing masing adalah…
- 30% dan 20%
- 40% dan 20%
- 50% dan 20%
- 50% dan 30%
- 60% dan 40%
Soal No.16
Pada keadaan isobarik suatu gas yang bervolume 2 m3 dipanaskan secara perlahan-lahan dan volumenya berubah menjadi 4 m3 . Dengan bertambahnya volume maka timbul usaha luar gas sebesar 6 x 105 J. Besar tekanan gas adalah …
- 3 x 105 N/m2
- 4 x 105 N/m2
- 5 x 105 N/m2
- 6 x 105 N/m2
- 7 x 105 N/m2
PEMBAHASAN :
Diketahui:
V1 = 2 m3
V2 = 4 m3
W = 6 x 105 J
Maka untuk menghitung besar tekanan pada keadaan isobaric sebagai berikut: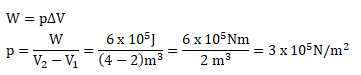
Jawaban : A
Soal No.17
Perhatikan gambar grafik di bawah ini!

Dari grafik di atas, dapat kita hitung besar perbandingan usaha luar gas pada keadaan I dan II adalah …
- 4 : 3
- 5 : 6
- 2 : 3
- 2 : 1
- 1 : 1
PEMBAHASAN :
Diketahui:
Keadaan I:
P1 = 25 N/m2
V11 = 10 m3
V12 = 30 m3
Keadaan II:
P2 = 25 N/m2
V21 = 20 m3
V22 = 50 m3
Maka, menghitung besar perbandingan usaha luar gas keadaan I dan II sebagai berikut:
Jawaban : B
Soal No.18
Gas Nitrogen (N2 ) dengan massa 280 gr ditekan secara isotermis pada suhu 470 C sehingga volumenya menjadi 0,5 volume semula. Maka kerja luar gas yang dikeluarkan sebesar … (BM nitrogen = 28 ; ln 0,5 = – 0,69; R = 8,31 J/molK)
- 11.215 J
- 12.444 J
- 25.669 J
- 18.349 J
- 15.331 J
PEMBAHASAN :
Diketahui:
Massa Nitrogen = 280 gr
T tetap = 470 C = (47 + 273) K = 320 K
V2 = 0,5 V1
BM nitrogen = 28
ln 0,5 = – 0,69
R = 8,31 J/mol K
Maka besar kerja luar gas dapat dihitung sebagai berikut: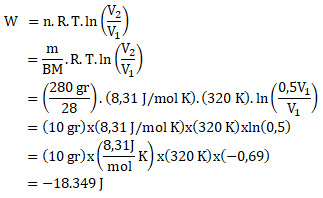
Besar kerja luar gas bernilai negatif berarti sistem menerima kerja luar.
Jawaban : D
Soal No.19
Gas helium dengan volume 6 x 10-2 m3 dinaikkan volumenya menjadi 5 kali lipatnya pada keadaan isobarik. Usaha luar yang dilakukan gas pada sistem sebesar 4 x 105 J. Maka besar tekanan gas adalah …
- 17,21 x 105 N/m2
- 18,11 x 105 N/m2
- 12,63 x 105 N/m2
- 16,67 x 105 N/m2
- 17,17 x 105 N/m2
PEMBAHASAN :
Diketahui:
V1 = 6 x 10-2 m3
V2 = 5 x V1 = 5 x (6 x 10-2 m3 ) = 30 x 10-2 m3
W = 4 x 105 J
Maka, besar tekanan gas adalah: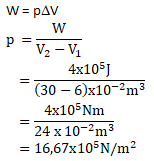
Jawaban : D
Soal No.20
Pada keadaan isokhorik suatu gas mengalami kenaikan suhu dari 25C menjadi 400 C. Besar tekanan gas awal sebesar 15 Pa. Maka besar usaha luar gas adalah …
- 1 x 102 J
- 12 x 102 J
- 0 J
- 2 x 102 J
- 3 x 102 J
PEMBAHASAN :
Diketahui:
T1 = 25C
T2 = 40C
P = 15 Pa
Maka besar usaha luar gas dapat dihitung sebagai berikut:
W = pΔV
Sistem dalam keadaan isokhorik (volume tetap) ΔV = 0 maka:
W = p. 0 = 0
Jawaban : C
Soal No.21
Pada kinerja silinder mesin diesel terjadi pemampatan udara melalui proses adiabatik. Mula-mula volume udara 100 cm3 dengan suhu 470 C dan tekanan 1 Atm. Setelah dimampatkan volumenya menjadi 20 cm3 . Suhu setelah dimampatkan adalah …
- 650 K
- 609 K
- 500 K
- 550 K
- 450 K
PEMBAHASAN :
Diketahui:
V1 = 100 cm3 = 100 x 10-6 m3
T1 = 470 C = (47 + 273)K = 320 K
P1 = 1 Atm = 1 x 105 N/m2
V2 = 20 cm3 = 20 x 10-6 m3
γ = 1,4
Maka, untuk menghitung suhu akhir udara adalah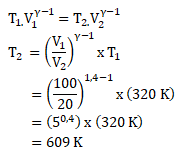
Jawaban : B
Soal No.22
Dengan usaha luar gas sebesar 150 J, suatu sistem mengalami proses adiabatik. Perubahan energi dalam sistem adalah sebesar ΔU dan kalor yang terserap dalam sistem adalah sebesar Q, pernyataan yang benar adalah….
- Q = 0
- ΔU = – 15 J
- ΔU + Q = – 150 J
- ΔU = 150 J
- ΔU = -10 J
PEMBAHASAN :
Diketahui:
W = – 150 J
Q = 0 (proses dalam sistem secara adiabatik)
Maka, berdasarkan hukum I Termodinamika adalah:
ΔU + W = Q
ΔU = – W
ΔU = – (- 150 J)
ΔU = 150 J
Jawaban : D
Soal No.23
Jika diketahui 4 mol gas monoatomik pada suhu 30oC dengan tekanan awal 4 x 105 Pa mengalami proses isokhorik sehingga mencapai tekanan akhir 6 x 105 Pa. Jika diketahui tetapan gas umum (R = 8,31 J/mol K), maka perubahan energi dalam yang terjadi adalah….
- 7.553,79 J
- 8.766,98 J
- 9.876,99 J
- 9.998,89 J
- 10.234,66 J
PEMBAHASAN :
Diketahui:
Mol gas monoatomik (n) = 4 mol
T awal (T1) = 30oC = (30 + 273) K = 303 K
Tekanan Awal (P1) = 4 x105 Pa
Tekanan akhir (P2) = 6 x 105 Pa
R = 8,31 J/mol K
Menentukan suhu akhir setelah proses isokhorik berlangsung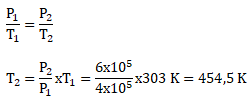
Menentukan energi dalam berdasarkan hukum I Termodinamika
ΔU = QV = CV DT = 3/2 nRDT = 3/2 nr(T2 – T1)
ΔU = 3/2 (4 mol)(8,31 J/mol K) (454,5 – 303)K = 7.553,79 J
Jawaban : A
Soal No.24
Suatu gas yang memiliki volume 10 m3 pada suhu 27oC dan tekanan 8 x 105 Pa. Volume gas tersebut dalam keadaan standar (STP) adalah….
- 45 m3
- 54 m3
- 63 m3
- 72 m3
- 85 m3
PEMBAHASAN :
Diketahui:
Volume awal (V1) = 10 m3
Suhu awal (T1) = 27oC = (27 + 273) K = 300 K
Tekanan awal (P1) = 8 x 105Pa
Suhu akhir (T2) = 0oC (STP) = (0 + 273)K = 273 K
Tekanan akhir (P2) = 1 atm (STP) = 1,01 x 105 Pa
Maka volume gas pada keadaan standar (STP) adalah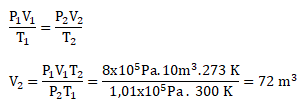
Jawaban : A
Soal No.25
Mesin kalor yang bekerja sesuai prinsip siklus carnot pada suhu reservoir tinggi 2270 C dan efisiensi mesin 30%, maka banyak kalor yang dibuang ke reservoir memiliki suhu …
- 550 C
- 770 C
- 660 C
- 440 C
- 330 C
PEMBAHASAN :
Diketahui:
T1 = 2270 C = (227 + 273)K = 500 K
η = 30%
Maka untuk menghitung suhu pada reservoir rendah sebagai berikut:
T2 = (1 – h) x T1= (1 – 0,3) x 500 K
T2 = 0,7 x 500 K = 350 K
Satuan kelvin kita ubah menjadi celcius, sebagai berikut:
T = (350 – 273)0 C = 770 C
Jawaban : B
Soal No.26
Pada sistem mesin carnot menerima usaha sebesar 3.500 J dari reservoir panas dan 2.500 J pada reservoir dingin. Besar efisiensi mesin carnot tersebut adalah …
- 34 %
- 23 %
- 13,5 %
- 11,2%
- 28,57%
PEMBAHASAN :
Diketahui:
Kalor pada reservoir panas, Q1 = 3.500 J
Kalor pada reservoir dingin, Q2 = 2.500 J
Maka, besar efisiensi mesin carnot dapat dihitung sebagai berikut:![]()
Jawaban : E
Soal No.27
Pada sebuah kulkas mempunyai suhu terendah di dalam freezer – 120 C dengan suhu di luar kulkas 270 C. Besar koefisien performansi kulkas tersebut adalah …
- 5
- 6
- 7
- 8
- 9
PEMBAHASAN :
Diketahui:
suhu di luar, T1 = 270 C = (27 + 273) K = 300 K
suhu di dalam T2 = -120 C = (-12 + 273) K = 261 K
maka, besar koefisien performansi kulkas dapat dihitung sebagai berikut: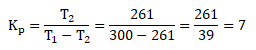
Jawaban : C
Soal No.28
Suhu pada mesin refrigerator bagian dalam – 50 C dan suhu pada bagian luarnya 280 C. untuk mengaktifkan mesin refrigerator tersebut memerlukan daya sebesar 300 watt. Besar panas yang dikeluarkan dari ruangan tiap jamnya adalah …
- 756.009 J
- 778.996 J
- 961.595 J
- 911.008 J
- 877.221 J
PEMBAHASAN :
Diketahui:
T2 = – 5 C = (- 5 + 273) K = 268 K
T1 = 280 C = (28 + 273) K = 301 K
P = 300 watt
Rentang waktu refrigerator menggunakan listrik (t) = 1 jam = 3.600 sekon
Menentukan kalor penggunaan listrik refrigerator selama 1 jam
Q1 = P . t
. = 300 watt . 3.600 sekon
. = 1.080.000 J
Menentukan besar kalor yang dikeluarkan dari refrigerator selama 1 jam![]()
Jawaban : C
Soal No.29
Sebuah mesin pendingin memiliki koefisien performansi 5 dengan suhu ruangan di luar mesin pendingin 260 C. maka suhu terendah di dalam mesin pendingin adalah …
-
-
- – 300 C
- – 200 C
- – 290 C
- – 150 C
- – 240 C
-
PEMBAHASAN :
Diketahui:
T1 = 260 C ® (26 + 273)K = 299 K
Kp = 5
Maka untuk menghitung T2 sebagai berikut: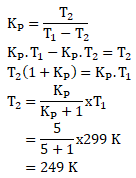
Merubah satuan derajat kelvin ke derajat Celsius:
(249 – 273) 0 C = – 240 C
Jawaban : E
Semoga Bermanfaat