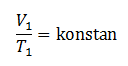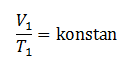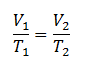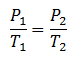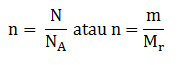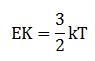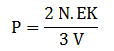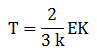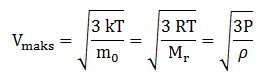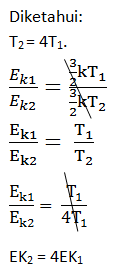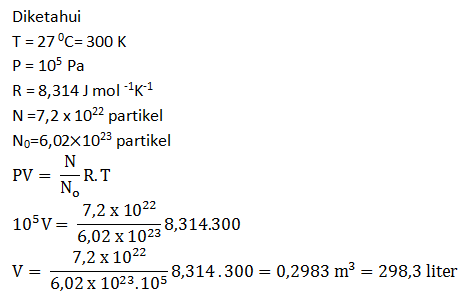Untuk Pembelajaran selanjutnya…
GAS IDEAL
Sifat-Sifat Gas Ideal
- Berlaku hukum Newton tentang gerak
- Partikel gas selalu bergerak secara acak atau sembarangan.
- Tidak ada gaya tarik menarik/interaksi antarmolekul.
- Ukuran molekul gas dapat diabaikan terhadap ukuran ukuran ruangan tempat gas berada.
- partikel gas terdistribusi merata dalam ruangan.
- Tumbukan antar partikel bersifat lenting sempurna.
Hukum-hukum tentang Gas
Hukum Boyle
“pada suhu yang dibuat tetap, perkalian tekanan dan volume selalu konstan/tetap”.
Sehingga berlaku persamaan berikut :
PV = konstan
P1V1 = P2V2
Hukum Charles
“pada tekanan yang dibuat tetap, hasil bagi volume terhadap suhu akan selalu bernilai konstan/tetap”.
atau :
“pada volume yang dibuat tetap, hasil bagi tekanan terhadap suhu akan selalu bernilai konstan/tetap “.
atau:
Hukum boyle-gay lussac
merupakan gabungan dari hukum boyle ,hokum charles , dan hokum gay lussac .di dapat persamaan berikut:
Keterangan :
P1= Tekanan awal (N/m2)
P2=Tekanan akhir (N/m2)
V1=Volume awal(m3)
V2=Volume akhir (m3)
T1=Suhu awal (K)
T2=suhu akhir (K)
Persamaan umum gas ideal
Dirumuskan sebagai berikut:
PV = NkT atau PV = nRT
Keterangan:
P = tekanan gas ideal (N/m2)
V = volume gas ideal(m3)
N = jumlah molekul zat
n = jumlah mol
k = konstanta Boltzmann(dimana k = 1,38 x 10-23J/K)
R = konsanta gas umum (dimana R=8,31J/Mol K)
T = suhu gas ideal (K)
mol zat (n) dapat ditentukan dengan persamaan.
Keterangan:
N = jumlah molekul zat
NA=bilangan Avogadro (6,02 x 1023 partikel)
m= massa partikel gas (gram)
Mr=massa relatif molekul gas
Hubungan Kecepatan Partikel Gas, Energi Kinetik Dan Tekanan
Dalam gas ideal tekanan , suhu, dan kecepatan dapat ditentukan dengan persamaan berikut.
Energi kinetik
Tekanan gas
Suhu gas
Kecepatan efektif
Keterangan:
N = jumlah partikel zat
EK = energi kinetik rata-rata(J)
M0 = massa partikel gas (kg)
Mr = massa molekul relatif (kg/mol)
ρ = massa jenis gas ideal(kg/m3)
k = konstanta Boltzmann(dimana k = 1,38 x 10-23J/K)
R = konsanta gas umum (dimana R=8,31J/Mol K)
T = suhu (kelvin)
Energi Dalam
yaitu energi kinetik partikel gas yang terdapat di dalam suatu ruang tertutup
U = N.Ek = Nf(½ KT)
Keterangan:
N =jumlah partikel
Ek = energi kinetik
f = derajat kebebasan
- Gas monoatomic(f=3 seperti He , Ne, dan Ar)
- Gas diatomi seperti H2,O2,N2
Suhu rendah (T = ±250k ), f=3
Suhu rendah (T = ±500k), f=5
Suhu tinggi (T= ± 1000 k ), f=7
Mau Belajar Privat Online Lewat Zoom Bersama Tim Guru Kami?
Soal No.2 (SBMPTN 2018)
Suatu bejana kokoh yang berisi gas ideal dikocok berulang-ulang. Manakah pernyataan yang benar tentang keadaan gas tersebut setelah dikocok?
- Temperatur gas bertambah meskipun energi dalamnya tetap
- Temperatur gas bertambah tanpa gas melakukan usaha
- Energi dalam gas berkurang karena sebagian berubah mejadi kalor
- Gas melakukan usaha sebesar penambahan energi dalamnya
- Temperatur gas bertambah sebanding dengan penambahan kelajuan molekul gas
PEMBAHASAN :
Dari rumusan kecepatan efektif gas ideal kita dapat melihat hubungan temperatur dan kelajuan molekul gas![]()
Dari rumusan tersebut terlihat bahwa temperatur (T) dengan kelajuan molekul gas (vrms) sebanding. Maka jika temperatur dinaikan maka terjadi penambahan kelajuan molekul gas
Jawaban : E
Soal No.3 (SBMPTN 2016)
Gas Argon dianggap sebagai gas ideal. Gas itu mula- mula mempunyai energi dalam Ei dan temperatur Ti. Gas tersebut mengalami proses dengan melakukan usaha W, melepaskan energi senilai Q, dan keadaan akhir energi dalam Ef serta temperatur Tf. Besarnya perubahan energi tersebut digambarkan seperti gambar berikut.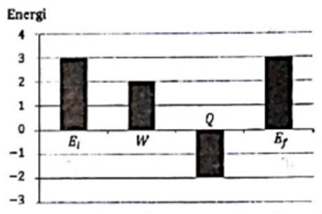
Apa simpulan proses tersebut.
- Gas mengalami proses isobarik dan Tf < Ti
- Gas mengalami proses adiabatik dan Tf < Ti
- Gas mengalami proses isokhorik dan Tf < Ti
- Gas mengalami proses isotermal dan Tf = Ti
- Gas mengalami proses isokhorik dan Tf = Ti
PEMBAHASAN :
Diketahui dari grafik
Ei = Ui = 3 J
Ef = Uf = 3 J
Menentukan energi dalam (ΔU)
ΔU = UF – Ui
ΔU = 3 – 3
ΔU = 0
ΔU = 3/2 n. R. ΔT
0 = 3/2 n. R. ΔT
Maka ΔT = 0, karena n ≠ 0
Karena ΔT = 0, maka tidak terjadi perubahan suhu atau disebut isotermis
Tf = Ti
Jawaban : D
Soal No.4 (UN 2014)
Suatu gas ideal berada dalam suatu bejana tertutup dengan tekanan P, volume V,dan suhu T. Jika suatu saat suhu diubah menjadi 2T dan volumenya menjadi 3/2 V maka perbandingan tekanan awal (P2) setelah V dan T diubah adalah…
- 1:3
- 1:2
- 2:3
- 3:4
- 4:3
PEMBAHASAN :
Soal No.5 (UN 2012)
Dalam wadah tertutup terdapat 2 liter gas pada suhu 27oC dan bertekanan 2 atm. Jika tekanan ditambah 2 atm pada kondisi isokhorik maka suhu gas menjadi….
- 600 oC
- 450 oC
- 327 oC
- 300 oC
- 54 oC
Soal No.6 (SNMPTN 2010)
tekanan suatu gas ideal dalam suatu tabung dilipat duakan dengan volume dipertahankan tetap. Jika gas dianggap bersifat ideal maka perbandingan kelajuan rms (Vrms)keadaan awal dan keadaan akhir adalah ….
- 4
- 2
- 1/√2
- √2
- 1/2
PEMBAHASAN :
Jawaban : C
Soal No.7 (UN 2010)
Suhu gas ideal dalam tabung dirumuskan sebagai Ek = 3/2 kT, T menyatakan suhu mutlak dan E menyatakan energi kinetik rata-rata molekul gas. Berdasarkan persamaan di atas….
- Makin tinggi suhu gas, energi kinetiknya makin kecil
- Makin tinggi suhu gas, gerak partikel gas makin lambat
- Makin tinggi suhu gas, gerak partikel makin cepat
- Suhu gas berbanding terbalik dengan energi kinetik gas
- Suhu gas tidak mempengaruhi gerak partikel gas
PEMBAHASAN :
Dari rumus Ek = 3/2 kT, suhu berbanding lurus dengan energi kinetik. Jika suhu dinaikkan maka energi kinetiknya makin besar. Semakin besar energi kinetik gerak partikel gas akan bergerak semakin cepat
Jawaban : C
Soal No.8 (SNMPTN 2010)
suhu gas nitrogen pada saat kelajuan rms-nya (root mean square) sama dengan v1 adalah 300 K jika kelajuan rms gas nitrogen diperbersar menjadi dua kali dari v1 maka suhu gas nitrogen tersebut berubah menjadi ……….
- 425 K
- 600 K
- 1.146 K
- 1.200 K
- 2. 292 K
PEMBAHASAN :
Jawaban : D
Soal No.9 (UN 2009)
Sejumlah gas ideal dalam tabung tertutup dipanaskan secara isokhorik sehingga suhunya naik menjadi 4 kali suhu semula. Energi kinetik rata-rata molekul gas ideal menjadi…
- ¼ kali semula
- ½ kali semula
- Sama dengan semula
- 2 kali semula
- 4 kali semula
Soal No.10 (UN 2014)
Suatu gas ideal dengan tekanan P volume V dalam ruangan tertutup. Jika tekanan gas dalam ruangan tersebut diturunkan menjadi ¼ kali semula pada volume tetap maka perbandingan energi kinetik sebelum dan sesudah penurunan tekanan adalah ….
- 1 : 4
- 1 : 2
- 2 : 1
- 4 : 1
- 5 : 1
Soal No.11 (UM UGM 2013)
Banyaknya partikel gas argon di dalam tabung pada suhu C dan tekanan 1 atm (1 atm Pa) adalah 7,2 x 1022 partikel. Jika konstanta gas umum = 8,314 Jmol-1 dan banyaknya partikel dalam K-1 mol gas No = 6,02 x 1023 partikel maka volume gas argon adalah ….
- 2.983,1 liter
- 1.964,2 liter
- 298,3 liter
- 196,4 liter
- 94,2 liter
Semoga Bermanfaat