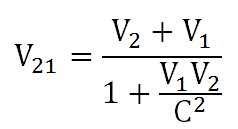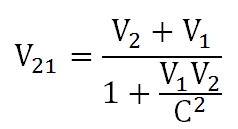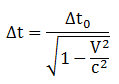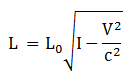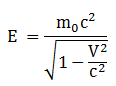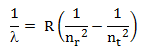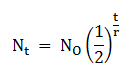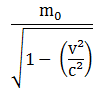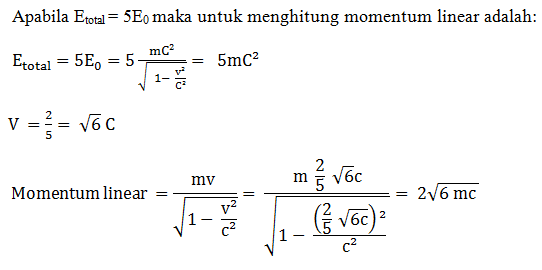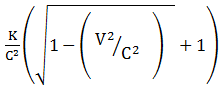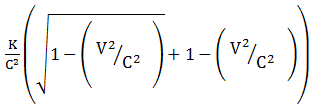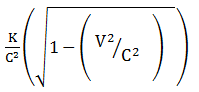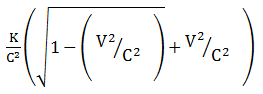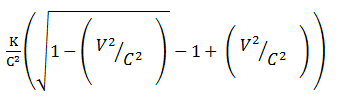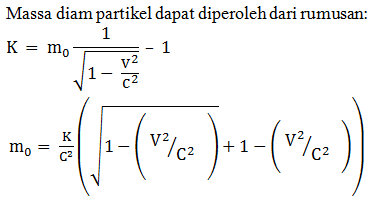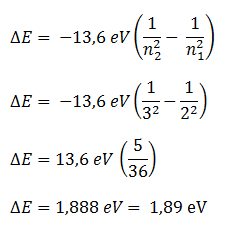Untuk Pembelajaran selanjutnya…
Relativitas Khusus
Teori relativitas menyelidiki bagaimana pengukuran suatu besaran fisika bergantung pada pengamat seperti halnya dengan peristiwa yang diamati.
Relativitas Newton
Teori relativitas Newton digunakan untuk benda-benda yang memiliki kecepatan lebih rendah daripada kecepatan cahaya.
Relativitas Einstein
Teori relativitas Einstein berlaku umum, berbeda dengan teori relativitas Newton yang hanya berlaku untuk benda-benda yang bergerak dengan kecepatan jauh lebih kecil daripada kecepatan cahaya. Einstein memperkenalkan teori relativitas khusus dengan merevisi teori relativitas Newton. Persamaan relativitas kecepatan menurut Einstein adalah:
Postulat Einstein
Einstein mengemukakan dua postulat dalam teori relativitas khusus, yaitu:
- Postulat Pertama
Hukum-hukum fisika memiliki bentuk yang sama pada setiap kerangka acuan inersia. Postulat ini dikemukakan karena tidak adanya kerangka acuan yang berlaku umum sebagai acuan mutlak dan merupakan perluasan dari teori relativitas Newton. - Postulat Kedua
Kecepatan cahaya di ruang hampa ke segala arah adalah selalu sama untuk semua pengamatan dan tidak bergantung pada kecepatan sumber cahaya atau pengamat.
c =3 x 108 m/s
Postulat ini memiliki implikasi yang sangat luas terhadap kecepatan, panjang, waktu, dan massa benda semuanya bersifat relatif dan tidak berlaku pada relativitas Newton.
Dilatasi Waktu
Keterangan:
Δt = selang waktu menurut pengamat yang bergerak terhadap kejadian
Δto = selang waktu menurut pengamat yang diam terhadap kejadian (s)
Kontraksi Panjang
ket:
L = panjang benda saat bergerak relatif terhadap kerangka diam
L0 = panjang benda yang diam pada suatu kerangka acuan
v = kecepatan benda relatif terhadap kerangka diam
Massa dan Energi Relativitas
Massa Relativitas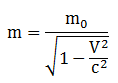
keterangan :
m0 = massa diam
v = kecepatan relatif terhadap pengamat
Energi Kinetik
Ek = E – E
Fisika Atom
Teori Atom Demokritus
Menurut teori atom Demokritus, atom berasal dari kata atomos (bahasa Yunani) yaitu tidak dapat dibagi-bagi lagi.
Teori Atom Dalton
Seorang ahli kimia bernama John Dalton mendukung pemikiran Demokritus dengan melakukan eksperimen kimia dan menemukan beberapa ciri-ciri atom, yaitu:
- Atom tersusun dari partikel-partikel yang sangat kecil yang tidak dapat dibagi lagi.
- Tersusun dari unsur-unsur yang atom-atomnya sama dan tidak dapat berubah menjadi atom unsur
- Molekul adalah bagian dari senyawa yang terkecil. Dua atom atau lebih yang berasal dari unsur-unsur yang berlainan dapat membentuk suatu molekul.
- Atom-atom dipisahkan oleh reaksi kimia, kemudian bergabung lagi dengan susunan yang berbeda dari semula dengan massa keseluruhan tetap.
Kelemahan dari teori atom Dalton adanya tidak menjelaskan tentang adanya muatan listrik dalam atom.
Teori Atom Thomson
Pada tahun 1856-1940 JJ. Thomson mengubah pandangan tentang atom, yaitu ditemukannya muatan negatif pada atom yang disebut dengan elektron. Berdasarkan penemuannya Thomson menemukan ciri-ciri atom antara lain:
- Atom berbentuk bola pejal dan memiliki muatan positif dan muatan negatif yang tersebar merata di seluruh bagian atom.
- Atom merupakan partikel yang dapat dibagi-bagi.
- Partikel-partikel pembentuk atom tersebar merata, sehingga atom bersifat masif.
- Atom bersifat netral karena jumlah muatan positif sama dengan jumlah muatan negati
- Massa elektron jauh lebih kecil dari massa atom.
Kelemahan teori atom Thomson adalah:
- Massa atom tersebar merata.
- Belum ditemukannya besar massa muatan elek
Teori Atom Rutherford
Pada 1871-1937 Ernest Rutherford berhasil memecahkan kelemahan teori atom Thompson dengan eksperimen menggunakan berkas partikel alfa yang ditambahkan ke lempeng tipis emas. Dari penelitiannya, terlihat sebagian besar partikel alfa dapat dengan mudah menembus lempeng, tetapi ada sebagian partikel alfa yang di hamburkan kembali. Partikel alfa yang dihamburkan kembali oleh inti atom merupakan muatan positif sejenis dengan muatan yang di tembakkan oleh partikel alfa.
Menurut Rutherford ada beberapa yang dikemukakan, antara lain:
- Inti atom bermuatan positif mengandung hampir seluruh massa atom.
- Inti atom selalu dikelilingi oleh elektron bermuatan negatif.
- Jumlah muatan inti = jumlah muatan elektron yang mengelilinginya.
- Selama mengelilingi inti, gaya sentripetal elektron dibentuk oleh gaya tarik elektrostatis (gaya coulomb) inti atom dan elektron.
Kelemahan dari atom Rutherford adalah:
- Tidak dapat menjelaskan kestabilan inti atom
- Tidak dapat menjelaskan spektrum garis atom hi
- Elektron yang mengelilingi inti akan terus memancarkan energi berupa gelombang elekromagnet sehingga lintasannya berbentuk spiral dan suatu saat akan jatuh ke dalam inti.
Teori Atom Bohr
Pada tahun 1885-1962 Niels Bohr menyempurnakan kelemahan teori atom Rutherford. Postulat-postulat yang diajukan Bohr adalah sebagai berikut:
- Elektron mengelilingi inti atom hanya dalam lintasan lingkaran tertentu.
- Elektron memiliki energi tertentu pada setiap orbit. Orbit ini disebut orbit stasioner. Orbit ini bergerak tanpa meradiasikan energi.
- Energi radiasi yang di pancarkan atom berupa foron tunggal berenergi. Energi radiasi terjadi hanya ketika elektron berpindah dari orbit stasioner satu ke orbit stasioner lainnya yang lebih rendah.
E = hf = Et – Er
Keterangan:
Et = energi orbit yang lebih tinggi
Er = energi orbit yang lebih rendah.
Energi dasar pada atom hidrogen E1 bernilai -13,6 eV, sedangkan untuk atom berelektron n dapat dinyatakan dalam persamaan berikut: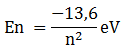
- Momentum sudut yang memenuhi keadaan kuantum:

Keterangan:
L = momentum sudut (Ns)m = massa elektron = 9,1 x 10-31 kgrn = jari-jari orbit ke-nh = konstanta planck = 6,63 x 10-34 Jsn = bilangan kuantum 1, 2, 3, …Dengan:- Bilangan kuantum berkaitan dengan kulit atom K, L, M, N, …
- Jari-jari atom hidrogen menurut Bohr bernilai r1 = 0,53 A
Sehingga, jari-jari atom berelektron n dapat dirumuskan sebagai berikut:
rn = n2 r1
Keterangan:
rn = Jari-jari atom berelektron n
n = bilangan kuantum/kulit atom
Kelemahan dari teori atom Bohr adalah lintasan elektron tidak sesederhana seperti yang dinyatakan Bohr. Selain itu, teori atom Bohr tidak dapat menjelaskan kejadian dalam ikatan kimia, pengaruh medan magnet terhadap atom (Efek Zeernam), dan tidak bisa menjelaskan spektrum atom berelektron banyak.
Deret atom hidrogen sebagai berikut:
Deret Balmer : nr = 1 dan nt = 2, 3, 4, … dst
Deret Lyman : nr = 2 dan nt = 3, 4, 5, … dst
Deret Paschen : nr = 3 dan nt = 4, 5, 6, … dst
Deret Brachet : nr = 4 dan nt = 5, 6, 7, … dst
Deret Pfund : nr = 5 dan nt = 6, 7, 8, … dst
Keterangan:
λ = panjang gelombang (m)
R = konstanta Rydberg = 1,0074 x 107 m-1
Fisika Inti dan Radioaktivitas
Inti Atom
Berdasarkan sistem periodik unsur, atom dapat dituliskan sebagai berikut:
Keterangan:
A = nomor massa atom yang menunjukan jumlah proton dan neutron pada inti
Z = nomor atom yang menunjukkan jumlah proton
X = nama unsur atom
Sehingga secara matematis jumlah neutron dapat dituliskan sebagai berikut:
N = A- Z
Keterangan:
N = jumlah neutron
A = jumlah proton dan neutron
Z = jumlah proton
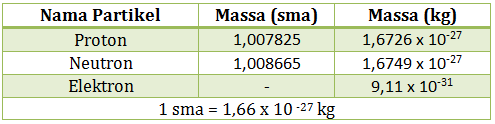
Beberapa contoh lambang unsur dan partikel, lihat tabel di bawah ini:
Defek Massa
Selisih antara massa nukleon dan massa inti disebut defek massa. Inti atom tersusun oleh proton dan neutron, sedangkan jumlah massa proton dan massa neutron (massa nukleon) selalu memiliki massa inti lebih kecil daripada massa nukleon.
Secara matematis dapat dinyatakan sebagai berikut:
Δm = (Zmp + N mn) – minti
Keterangan:
Δm = defek massa
mp = massa proton
mn = massa neutron
minti = massa inti atom
Dengan:
Defek inti atom dapat disetarakan dengan satuan energi dalam eV (elektron volt) yakni 1 sma = 931 MeV (mega elektron volt).
Beberapa partikel dan massanya dalam sma maupun kg, perhatikan tabel di bawah ini:
Energi Ikat Inti Atom
Energi ikat inti adalah massa defek yang berubah menjadi energi yang mengikat inti. Jika m dalam kg, maka:
Eikat = Δmc2 Joule
Sedangkan m dalam sma adalah:
Eikat = Δm 931 MeV
Keterangan:
Eikat = energi ikat inti atom
c = 3 x 108 m/s
Energi ikat rata-rata tiap nukleon/inti atom dapat dirumuskan dalam persamaan berikut:
Keterangan:
Enukleon = energi ikat rata-rata tiap nukleon/inti atom
A = jumlah nukleon (proton dan elektron)
Radioaktivitas Inti
Pemancaran Partikel Radioaktif
Radioaktivitas adalah peristiwa pemancaran sinar radioaktif secara spontan. Pemancaran partikel-partikel tersebut diakibatkan karena ketidakstabilan inti atom. Beberapa contoh pemancaran partikel-partikel radioaktif adalah sebagai berikut:
Pemancaran partikel α
Pemancaran partikel β
Pemancaran partikel γ
Keterangan:
X = Inti atom awal
Y = Inti atom hasil
E = Energi yang dihasilkan
Peluruhan Inti Atom
Peluruhan inti atom terjadi apabila inti atom memancarkan radioaktif secara terus-menerus yang berakibat jumlah inti atom berkurang/mengalami peluruhan. Jumlah inti yang mengalami peluruhan radioaktif secara matematis dapat dirumuskan sebagai berikut:
Keterangan:
Nt = jumlah inti pada keadaan akhir
NO = jumlah inti pada keadaan mula-mula
t = waktu peluruhan
T = waktu paroh
Konstanta peluruhan (λ) dapat ditentukan dengan persamaan sebagai berikut:
Reaksi Inti Atom Buatan
Reaksi inti atom, selain dapat melalui pemancaran radioaktif, dapat terjadi juga secara buatan. Adapun reaksi yang dilakukan secara buatan antara lain:
Reaksi Fisi
Reaksi fisi adalah reaksi pembelahan inti berat menjadi inti-inti yang lebih ringan. Contoh: reaksi nuklir.
1n + 92235U → 56141Ba + 3692Kr + 3 1n + Q
1n + 92235U → 54140Xe + 3894Sr + 2 1n + Q
Reaksi Fusi
Reaksi fusi adalah penggabungan inti-inti yang ringan menjadi inti yang lebih berat. Contoh: reaksi energi matahari
11H + 11H → 12H + 1e + 0,42 MeV
12H + 11H → 23H + + 5,49 MeV
23He + 23He → 24He +2 11H + 12,86 MeV
Energi Reaksi Inti Atom
Persamaan untuk energi yang dihasilkan oleh reaksi fusi maupun fisi adalah sebagai berikut:
E = |Σmakhir – Σmawal|931 MeV
Keterangan:
Σmawal = jumlah massa inti sebelum reaksi
Σmakhir = jumlah massa inti setelah reaksi
Jenis Ikatan Inti Atom
Jenis ikatan inti atom ada tiga, yaitu:
Isotop
isotop merupakan unsur yang mengandung nomor atom sama akan tetapi mempunyai massa berbeda.
contoh: 714N dan 715N, 614C dan 615C
Isoton
isoton merupakan unsur yang memiliki jumlah neutron sama.
contoh: 1531P dan 1632S, 2040Ca dan 1939K
Isobar
isobar merupakan unsur yang memiliki nomor massa sama, tetapi nomor atom berbeda.
Contoh: 614C dan 714N, 1224Mg dan 1124Na
Soal No.1 (SBMPTN 2018)
Dalam peluruhan sebuah inti 238U92 hingga stabil menjadi sebuah inti 206Pb82 dihasilkan sejumlah partikel alfa dan beta (elektron). Jumlah partikel alfa dan beta yang dihasilkan adalah….
- 8 alfa dan 6 beta
- 6 alfa dan 8 beta
- 8 alfa dan 4 beta
- 6 alfa dan 4 beta
- 6 alfa dan 6 beta
PEMBAHASAN :![]()
Dari persamaan di atas:
238 = 206 + 4x + 0
238 – 206 = 4x
32 = 4x
x = 8
Nilai y = x = 8
92 = 82+ 8.2 + m (-1)
92 = 82 + 16 – m
m = 98 – 92
m = 6
nilai z = m = 6
Dengan demikian Jumlah partikel alfa dan beta yang dihasilkan adalah 8 alfa dan 6 beta
Jawaban A
Soal No.2 (UMPTN 1990)
Menurut Einsten, sebuah benda dengan massa diam setara dengan dengan c adalah kecepatan rambat cahaya di dalam hampa. Apabila benda bergerak dengan kecepatan v maka energi total benda setara dengan …
PEMBAHASAN :
Apabila m0 = m0 c2 .Maka, energi total benda setara dengan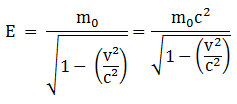
Jawaban : D
Soal No.3 (UN 2002)
Pada pemetaan lahan kompleks persegi sama dengan 4,0 km dan lebar sama dengan 2,5 km, luas lahan bila di ukur dari udara dengan kecepatan pesawat pengukur 0,6 c ( searah panjang lahan ) adalah …
- 8,0 km2
- 12,5 km2
- 15 km2
- 16,6 km2
- 17,5 km2
PEMBAHASAN :
Diketahui:
I = 2,5 km
v = 0,6 c (searah panjang lahan)
Menggunakan rumusan kontraksi panjang pada luas lahan, sebagai berikut: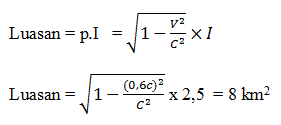
Jawaban : A
Soal No.4 (UMPTN 2000)
Perbandingan dilatasi waktu untuk sistem yang begerak pada kecepatan 0,8 c dengan sistem yang bergerak dengan kecepatan 0,6 c adalah …
- 3 : 4
- 4 : 3
- 9 : 2
- 9 : 16
- 16 : 9
PEMBAHASAN :
Diketahui:
v1 = 0,8 c
v2 = 0,6 c
Perbandingan dilatasi waktu pada soal di atas: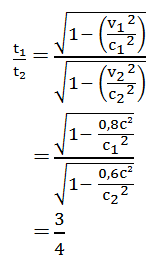
Jawaban : A
Soal No.5 (UN 2002)
Sebuah partikel dan foton memiliki energi yang sama apabila …
- Massanya sama
- Kecepatannya sama
- Momentumnya sama
- Arah rambatnya sama
- Medium yang melalui sama
PEMBAHASAN :
Partikel dan foton memiliki energi yang sama ketika momentumnya sama, sesuai rumusan:
E = hf = hC/A = pc
Jawaban : C
Soal No.6 (UM UGM 2005)
Sebuah partikel yang bergerak dengan kelajuan 0,3 C terhadap kerangka acuan laboratorium memancarkan sebuah elektron searah dengan kecepatan 0,3 C relatif terhadap partikel. Laju elektron tersebut menurut kerangka acuan laboratorium paling mendekati niainya dengan …
- 0,32 c
- 0,51 c
- 0,66 c
- 0,76 c
- 0,90 c
PEMBAHASAN :
Diketahui:
v1 = 0,3 c
v2 = 0,3 c
Maka laju elektron diperoleh: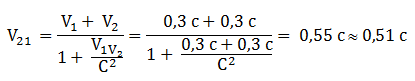
Jawaban : B
Soal No.7 (UN 2004)
Jarak dua kota di bumi adalah 800 km. Berapa jarak kedua kota tersebut bila di ukur dari sebuah pesawat antariksa yang terbang dengan kecepatan 0,6 c searah kedua kota?
- 640 km
- 650 km
- 660 km
- 670 km
- 680 km
PEMBAHASAN :
Diketahui:
L = 800 km
v = 0,6 c
Dengan konsep rumusan kontraksi panjang, jarak kedua kota: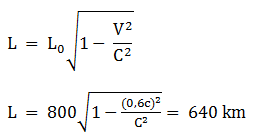
Jawaban : D
Soal No.8 (UM UGM 2004)
Energi total benda bermassa m sama dengan lima kali energi rehatnya. Jika benda tersebut mempunyai momentum linear sebesar …
- 2 √3 mc
- 4 √2 mc
- 6 mc
- 2 √6 mc
- 2 mc
Soal No.9 (UN 2014)
Sebuah pesawat memiliki panjang 95 m saat di bumi. Ketika pesawat bergerak dengan kecepatan v, menurut pengamat di bumi panjang pesawat adalah 76 m. Besar kecepatan v adalah …
- 0,25 c
- 0,50 c
- 0,60 c
- 0,75 c
- 0,80 c
PEMBAHASAN :
Diketahui:
L1 = 76 m
L = 95 m
Menggunakan persamaan dilatasi panjang, besarnya kecepatan:
Jawaban : C
Soal No.10 (UM UGM 2008)
Bila k adalah energi kinetik relativistik dari sebuah partikel dan v adalah kecepatannya maka massa diam partikel tersebut diberikan oleh …
Soal No.11 (UN 2013)
Kelemahan teori atom Rutherford adalah …
- Elektron yang mengelilingi inti atom akan menyerap energi
- Elektron menyebar merata di permukaan bola atom
- Elektron berputar mengelilingi inti seperti tata surya
- Elektron mengelilingi inti memancarkan gelombang elektromagnetik
- Atom terdiri dari muatan positif dan muatan negatif
PEMBAHASAN :
- Tidak dapat menjelaskan kestabilan inti atom.
- Tidak dapat menjelaskan spektrum garis atom hidrogen.
- Elektron yang mengelilingi inti akan terus memancarkan energi berupa gelombang elekromagnet sehingga lintasannya berbentuk spiral dan suatu saat akan jatuh ke dalam inti.
Jawaban : D
Soal No.12 (UMPTN 1991)
Dalam postulat Bohr tentang momentum sudut, tersirat sifat gelombang elektron. Panjang gelombang λ, elektron yang bergerak dalam suatu orbit berjari – jari r memenuhi … ( n adalah bilangan bulat )
- r = nλ
- 2r = n2λ
- 2r = nλ
- 2πr = nλ
- r = λ/n
PEMBAHASAN :
Berdasarkan postulat Bohr persamaan yang memenuhi adalah 2πr = nλ
Jawaban : E
Soal No.13 (UN 2013)
Pada model atom Bohr , energi elektron atom hidrogen pada keadaan dasar -13,6 eV. Jika elektron mengalami eksitasi dari kulit M ke kulit L maka besar perubahan energi elektron adalah …
- 1,89 eV
- 2,27 eV
- 3,4 eV
- 13,6 eV
- 68 eV
PEMBAHASAN :
Kulit atom dimulai dari K, L, M, N, … .Dari urutannya kulit L merupakan kulit ke – 2 sedangkan kulit M merupakan kulit ke – 3. Sehingga di peroleh besarnya energi elektron yang tereksitasi dari kulit M ke kulit L, yaitu:
Soal No.14 (UM UGM 2005)
Dalam spektrum pancaran atom Hidrogen, rasio antara panjang gelombang untuk radiasi (n = 2 ke n = 1) terhadap radiasi Balmer (n = 3 ke n = 2) adalah …
- 5/27
- 5/24
- 1/3
- 3
- 27/5
PEMBAHASAN :
Diketahui:
Panjang gelombang L, n = 2 ke n = 1
Panjang gelombang B, n = 3 ke n = 2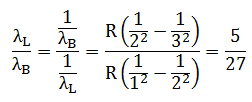
Jawaban : A
Soal No.15 (UN 2008)
Bola bekel bermasa 200 gram dijatuhkan dari ketinggian 80 cm tanpa kecepatan awal. Setelah menumbuk lantai bola bekel memantul kembali dengan kecepatan 1 m/s. Besar impuls pada bola saat mengenai lantai adalah… Ns
PEMBAHASAN :
Perhatikan gambar pada pilihan jawaban pada soal, gambar yang sesuai adalah gambar B. Karena atom karbon memiliki nomor masa Z = 6 dengan konfigurasi 2, 4 sehingga memiliki 2 elektron pada kulit pertama dan 4 elektron pada kulit ke – 2.
Jawaban : B
Soal No.16 (SBMPTN 2014)
Sebuah granat yang diam tiba – tiba meledak dan pecah menjadi 2 bagian yang bergerak dalam arah berlawanan. Perbandingan massa kedua bagian itu adalah m1 : m2 = 1 : 2. Bila energi yang dibebaskan adalah 3 x 105 joule maka perbandingan energi kinetik pecahan granat pertama dan kedua adalah ….
- 4,34 x 10-1 Å
- 4,34 x 100 Å
- 4,34 x 101 Å
- 4,34 x 102 Å
- 4,34 x 103 Å
Soal No.17 (UN 2013)
Kelemahan teori atom Rutherford adalah …
- elekron yang mengililingi inti atom akan menyerap energi
- elektron menyebar merata di permukaan bola atom
- elektron berputar mengelilingi inti seperti tata surya
- elektron mengelilingi inti memancarkan gelombang elektromagnetik.
- atom terdiri dari muatan positif dan elektron.
PEMBAHASAN :
Kelemahan dari teori atom Rutherford adalah elektron yang mengelingi inti akan terus memancarkan energi berupa gelombang elektromagnet sehingga lintasannya berbentuk spiral dan suatu saat akan jatuh ke dalam inti.
Jawaban : D
Soal No.18 (UMB UI 2008)
Dalam eksperimen Rutherford, sejumlah partikel alfa yang mulanya ditembakkan ke lempeng tipis emas ternyata dapat diamati bahwa sebagian kecil diantaranya dihamburkan pada sudut besar. Hamburan ini terjadi karena …
- Partikel alfa menumbuk partikel berat bermuatan negatif yang tersebar pada seluruh lenpeng emas
- Partikel alfa ditolak oleh partikel berat bermuatan positif yang tersebar pada seluruh lempeng emas
- Partikel alfa menumbuk partikel berat bermuatan negatif yang berkonsentrasi pada daerah kecil lempeng emas
- Partikel alfa ditolak oleh partikel berat bermuatan positif berkonsentrasi pada daerah kecil lempeng emas
- Partikel alfa bertumbukan dengan partikel alfa yang lain
PEMBAHASAN :
Hamburannya terjadi karena partikel alfa menumbuk partikel berat bermuatan negatif yang tersebar pada seluruh lempeng emas.
Jawaban : A
Soal No.19 (UN 2014)
Perbedaan model atom Rutherford dan Bohr adalah …
PEMBAHASAN :
Adanya perbedaan yang mencolok antara teori atom menurut Rutherford dan Bohr. Perbedaan itu adalah terkait gerak elektron dalam mengelilingi inti atom. Teori atom Rutherford belum mengenal adanya perpindahan lintasan.
Jawaban : D
Soal No.20 (UM UGM 2008)
Momentum sudut orbital yang tidak mungkin dimiliki oleh elektron dalam suatu atom adalah …
- √2 h
- √6 h
- √10 h
- 2√14 h
PEMBAHASAN :
Momentum sudut orbital yang tidak mungkin dimiliki elektron adalah 0. Karena momentum sudut orbital sebanding dengan jari-jarinya.
Jawaban : A
Soal No.21 (UN 2005)
Untuk bilangan kuantum utama n = 2, akan mempunyai bilangan kuantum orbital (I) yang bernilai …
- 0 dan 1
- 1 dan 2
- 2 dan 3
- 3 dan 4
- 4 dan 5
PEMBAHASAN :
Dari soal, untuk bilangan kuantum utama dengan n = 2 memiliki dua bilangan kuantum orbital yaitu 0 dan 1
Jawaban : A
Soal No.22 (SPMB 2007)
Pada suatu unsur radioaktif, jumlah yang meluruh tinggal 25% dari jumlah semula dalam waktu 20 menit. Bila mula-mula ada 1 kg unsur radioaktif tersebut, setelah jam massa radioaktif yang belum meluruh tinggal …
- 50 g
- 62,5 g
- 125 g
- 250 g
- 500 g
PEMBAHASAN :
Tentukan waktu paroh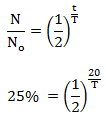
T = 10 menit
Apabila t = 30 menit dan = 1 kg =1000 gram
Maka massa radioaktif yang belum meluruh adalah: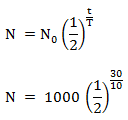 N = 125 gram
N = 125 gram
Jawaban : C
Soal No.23 (UN 2014)
Perhatikan reaksi inti fusi berikut ini:
1H₂ + 1H³ → ₂H⁴ + ₀n¹ + E
Jika massa ₁H² = 2,014 sma, massa 1H³ = 3,016 sma, massa partikel α = 4,0026 dan massa neutron = 1,0084 sma, maka energi yang dihasilkan adalah … (1 sma setara dengan 931 MeV )
- 18,62 MeV
- 17,69 MeV
- 16,76 MeV
- 15,73 MeV
- 14,89 MeV
PEMBAHASAN :
Diketahui:
massa ₁H² = 2,014 sma
massa 1H³ = 3,016 sma
massa 2H4 = 4,0026 sma
massa n1 = 1,0084 sma
Maka besar energi yang dihasilkan:
E = Δm. 931 MeV
E = [(m 1H2 + m 1H3) – (m 2H4 + m n1)]. 931 MeV
E = [(2,104 +3,016) – (4,0026 + 1,0084)]. 931 MeV
E = 0,019. 931 MeV
= 17,689 MeV ≈ 17,69
Jawaban : B
Soal No.24 (UM UGM 2008)
PEMBAHASAN :
Diketahui:
s = 60 m
t0 = 10-7 detik
Kecepatan dari partikel tersebut:
Jawaban : D
Soal No.25 (UN 2008)
Massa unsur radioaktif P mula mula X gram dengan waktu paroh 2 hari. Setelah 8 hari unsur yang tersisa Y gram . perbandingan antara X : Y = …
- 16 : 1
- 8 : 1
- 4 : 1
- 1 : 8
- 1 : 16
PEMBAHASAN :
Diketahui:
t = 8 hari
T = 2 hari
Untuk menghitung perbandingan X : Y dengan menggunakan rumus waktu paroh sebagai berikut: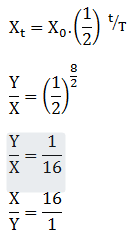
Jawaban : A
Soal No.26 (UMPTN 1996)
Jika pada proses fisi ini dibebaskan energi 200 MeV, massa neutron = 1,009 sma, massa inti = 235,04 sma dan 1 sma = 931 MeV maka massa inti (Ba + Kr) adalah … (dalam sma)
- 231,80
- 232,80
- 233,89
- 234,03
- 234,89
PEMBAHASAN :
Massa inti (Ba + Kr) adalah:
Dengan persamaan Defek Massa:
∆m = makhir – mawal
∆m = (mn + mu ) – (m(Ba+Kr) + 3mn)
∆m = (1,009 + 235,04) – (x-3.1,009)
Dengan E = ∆m.931 MeV
200 = (233,80 – x). 931
x = 232,80 sma
Jawaban : B
Soal No.27 (UN 2014)
Zat radiosotop C-14 dapat digunakan untuk …
- Mendeteksi fungsi kelenjar gondok
- Mengetahui efektivitas kerja jantung
- Membunuh sel kanker
- Mendeteksi pemalsuan keramik
- Menentukan usia fosil
PEMBAHASAN :
Beberapa kegunaan radioisotop diantaranya:
- Mendeteksi fungsi kelenjar gondok menggunakan radioisotop I-131.
- Mengetahui efektivitas kerja jantung menggunakan radioisotop Na-24.
- Membunuh sel kanker menggunakan radioisotop Co-60.
- Mendeteksi pemalsuan keramik menggunakan radioisotop Pb-210.
- Menentukan usia fosil menggunakan radioisotop C-14
Jadi, radioisotop C-14 memiliki kegunaan untuk menentukan usia fosil.
Jawaban : E
Soal No.28 (SBMPTN 2014)
Ketika suatu inti mengalami peluruhan radioaktif nomor massa inti yang baru adalah …
- selalu lebih besar dari nomor massa yang awal
- selalu lebih kecil dari nomor massa yang awal
- selalu sama dengan nomor massa yang awal
- tidak pernah lebih besar dari massa yang awal
- tidak pernah lebih kecil dari nomor massa yang awal
PEMBAHASAN :
Inti atom baru akan selalu lebih kecil dari nomor massa yang awal, karena peluruhan akan terjadi pada inti atom berat dengan memancarkan radioaktif agar inti lebih stabil.
Jawaban : B
Soal No.29 (UN 2004)
Grafik di bawah menunjukkan hubungan jumlah zat (N) terhadap waktu (t) pada peluruhan suatu unsur radioaktif. Waktu yang diperlukan sehingga unsur tersebut tinggal 1 mol adalah …
- 10 hari
- 20 hari
- 30 hari
- 40 hari
- 50 hari
PEMBAHASAN :
Diketahui:
N = 16 mol
N = 1 mol
T = 10 hari
Maka, waktu yang diperlukan sehingga unsur tersebut tinggal 1 mol adalah:
Jawaban : D
Soal No.30 (UM UGM 2013)
Umur paroh dari radium adalah 1600 tahun. Bila dalam sebongkah batu mengandung 0,2 gr Radium maka jumlah Radium dalam batu tersebut 12.800 tahun yang lalu adalah …
- 31,2 gram
- 41,2 gram
- 51,2 gram
- 61,2 gram
- 71,2 gram
PEMBAHASAN :
Diketahui:
N = 0,2 gram
t = 12.800 tahun
T = 1.600 tahun
Maka jumlah Radium (N) pada 12.800 tahun yang lalu adalah: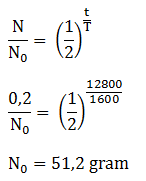
Jawaban : C
Soal No.31 (UN 2009)
Pernyataan yang terkait dengan penerapan radioisotop dalam bidang hidrologi:
(1) mengukur tinggi permukaan cairan dalam wadah tertutup
(2) mengukur endapan lumpur di pelabuhan
(3) menentukan letak kebocoran bendungan
(4) menentukan penyempitan pada pembuluh darah
Pernyataan yang benar adalah …
- (1), (2), (3), dan (4)
- (2), (3), dan (4) saja
- (1), (3), dan (4) saja
- (1), dan (4) saja
- (2) dan (3) saja
PEMBAHASAN :
Jawaban yang sesuai dengan pilihan adalah pernyataan nomor (2) dan (3) saja. Karena pernyataan nomor (4) bukan merupakan penerapan radioisotop dalam bidang hidrologi, melainkan dalam bidang kesehatan.
Jawaban : E
Semoga Bermanfaat