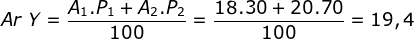Untuk Pembelajaran selanjutnya…
Soal No.1
Konfigurasi elektron atom X pada keadaan tereksitasi adalah [Ne] 3s2 3p2 4s1 3d1 . Konfigurasi elektron atom tersebut pada keadaan dasar adalah …
- [Ne] 3s2 3p3 4s1
- [Ne] 3s2 3p4
- [Ne] 3s2 3p3
- [Ne] 3s2 3p2
- [Ne] 3s2 3p1
PEMBAHASAN :
Diketahui konfigurasi suatu atom X pada keadaan tereksitasi adalah [Ne] 3s2 3p2 4s1 3d1. Maka pada keadaaan dasarnya elektron dibuat penuh pada 3p sehingga konfigurasinya menjadi [Ne] 3s2 3p4
Jawaban B
Soal No.2
Kelimpahan 2 isotop atom Y adalah 30% dan 70% dengan massa berturut-turut 18 sma dan 20 sma. Jika atom Y dapat membentuk senyawa CaY2 (Ar Ca = 40), maka Mr CaY2 adalah …
- 76,0
- 77,2
- 78,0
- 78,8
- 80,0
PEMBAHASAN :
Menentukan Ar Y dari isotop Y![]()
Maka Mr CaY2 = Ar Ca x 1 + Ar Y x 2
Mr CaY2 = 40 x 1 + (19,4 x 2) = 78,8
Jawaban D
Soal No.3
Molekul dengan perbedaan keelektronegatifan yang paling besar antar atom-atomnya adalah …
- ICI5
- IBr3
- BrCl3
- FBr5
- IF5
PEMBAHASAN :
Senyawa di atas merupakan senyawa antar halogen (Golongan VIIA)
Dalam satu golongan VIIA yang paling besar keelektronegatifannya yaitu F dan terkecil adalah I. Maka perbedaan yang paling besar terdapat pada senyawa IF5
Jawaban E
Senyawa XeF2 mem punyai struktur geometri berikut:
Diketahui symbol Lewis
Spesi berikut yang mempunyai struktur geometri sama dengan XeF2 adalah …
- SF2
- IF2 –
- NF2 –
- BrF2 +
- OF2
PEMBAHASAN :
Senyawa XeF2 menurut teori domain memiliki rumus AX2E3 yang memiliki bentuk linear. Akan memiliki struktur geometri yang sama dengan IF2 – yang memiliki rumus yang sama yaitu AX2E3 (linear) dengan struktur lewis sebagai berikut:
Jawaban B
Soal No.5
Reaksi pembakaran etana terjadi sebagai berikut:
C2H4(g) + 3O2(g) → 2CO2(g) + 2H2O(I)
Volume gas CO2 yang dihasilkan dari pembakaran 50 mL gas etana dengan 300 ml gas O2 pada suhu dan tekanan tetap adalah …
- 50 mL
- 100 mL
- 150 mL
- 200 mL
- 300 mL
PEMBAHASAN :
Pada suhu dan tekanan yang tetap berlaku hukum Gay Lussac (perbandingan volume akan memiliki perbandingan bulat dan sederhana) atau bisa dikatakan perbandingan volume akan sama dengan perbandingan koefisien. Untuk menentukan volume CO2 maka dapat ditentukan dari pereaksi pembatas (karena diketahui dua volume gas)
C2H4(g) + 3O2(g) → 2CO2(g) + 2H2O(I)
50 ml 300 ml
Pereaksi pembatasnya adalah C2H4 karena hasil bagi volume : koefisien = lebih kecil dibanding O2
maka Volume CO2 dapat diperoleh melalui perbandingan dengan volume C2H4![]()
Jawaban B
Soal No.6
Suatu senyawa organik mengandung unsur C, H, dan N. Pembakaran 1 mol senyawa tersebut menghasilkan 6 mol CO2 , 4 mol H2O, dan 2 mol NO2. Rumus empiris senyawa tersebut adalah …
- C3H4N
- C3H5N
- C3H6N
- C3H9N
- C6H8N
PEMBAHASAN :
Menentukan rumus empiris bisa diperoleh dari perbandingan unsur penyusunnya. Berarti kita akan membandingkan mol unsur C : H : N. Untuk memperoleh perbandingan tersebut diperlukan massa C, H dan N yang bisa diperoleh melalui massa senyawanya.
Menentukan massa C dari CO2![]()
![]()
Menentukan massa H dari H2O![]()
![]()
Menentukan massa N dari NO2![]()
![]()
Menentukan perbandingan mol C : mol H : mol N
mol C : mol H : mol N![]()
![]()
Karena perbandingannya 3 : 4 : 1 maka rumus empirisnya adalah
C3H4N
Jawaban A
Soal No.7
Campuran gas He, gas Ne, dan gas Ar memiliki tekanan total 1,0 atm. Jika dalam campuran terdapat 2 mol gas He dengan tekanan parsial 0,5 atm, jumlah seluruh gas dalam campuran tersebut adalah …
- 2 mol
- 4 mol
- 6 mol
- 8 mol
- 10 mol
PEMBAHASAN :
P parsial dapat diperoleh menggunakan rumus berikut:![]()
Menentukan n total (mol seluruh gas dalam campuran)![]()
Jawaban B
Data laju awal untuk reaksi (CH3 )3 CBr + OH – → (CH3 )3 COH + Br–
Pada 550 C diberikan pada tabel berikut:
| Konsentrasi Awal (M) | Laju awal (M/ detik) | |
| [(CH3 )3 CBr] | [OH – ] | |
| 0,1 | 0,1 | 0,02 |
| 0,2 | 0,1 | 0,04 |
| 0,3 | 0,1 | 0,06 |
| 0,1 | 0,2 | 0,02 |
| 0,1 | 0,3 | 0,02 |
Hukum laju reaksi ini adalah …
- r = k[(CH3)3CBr] [OH–]
- r = k[(CH3)3CBr]
- r = k[OH–]
- r = k[(CH3 )3CBr]2 [OH–]
- r = k[(CH3)3CBr] [OH–]2
PEMBAHASAN :
Menentukan orde (CH3 )3 CBr (x)
Cari [OH – ] yang sama (percobaan 2 dan 1) kemudian bandingkan![]()
![]()
2 = 2x
x = 1
Menentukan orde OH– (y)
Cari [(CH3 )3 CBr ] yang sama (percobaan 4 dan 1) kemudian bandingkan![]()
![]()
1 = 2y
y = 0
maka persamaan laju reaksinya:
r = k[(CH3)3CBr]
Jawaban B
Soal No.9
Pelarutan padatan MX2 terjadi sesuai kesetimbangan berikut:
MX2(s) ⇔ M2+(aq) + 2X–(aq)
Jika penguapan 100 mL larutan jenuh MX2 menghasilkan 1 mmol padatan MX2 , nilai Ksp senyawa tersebut adalah …
- 1 x 10 -4
- 4 x 10 -4
- 1 x 10 -6
- 4 x 10 -6
- 1 x 10 -8
PEMBAHASAN :
Menentukan kelarutan MX2 dari data volume dan mol![]()
Trik cepat menentukan Ksp
m = jumlah ion M2+ = 1 dan n = jumlah ion X– = 2
Ksp = (mm)(nn) sm+n
Ksp = (11)(22) s1+2 = 4s3 = 4 (10-2)3
Ksp = 4.10-6
Jawaban D
Soal No.10
Suatu larutan buffer asam diketahui mengandung 3 mol HA dengan tetapan ionisasi Ka dan 1 mol NaA. Jika ke dalam larutan ini ditambahkan 1 mol NaOH, nilai pH larutan yang terbentuk adalah …
- pH = pKa – log 3
- pH = pKa – log 2
- pH = pKa
- pH = pKa + log 2
- pH = pKa + log 3
PEMBAHASAN :
Larutan buffer asam yang terdiri dari HA (asam lemah) dan A– (basa konjugasi) dari NaA. Jika ditambah NaOH (menambahkan OH–) maka OH– akan bereaksi dengan asam lemah yaitu HA. Menurut reaksi:
maka pH yang terbentuk:![]()
ubah kedua sisi menjadi -log
-log (H+) = – log Ka
pH = pKa
Jawaban C
Soal No.11
Elektrolisis larutan yang mengandung ion WO42- selama 965 detik menghasilkan 0,005 mol logam wolfram (W) di katoda. Besarnya arus yang digunakan dalam elektrolisis ini adalah …
(F = 96500 C/mol)
- 0,5 A
- 1,0 A
- 1,5 A
- 2,5 A
- 3,0 A
PEMBAHASAN :
Untuk menentukan arus yang digunakan, dapat menggunakan Hukum Faraday I:![]()
![]()
n = 6 diperoleh dari jumlah elektron yang terlibat dalam reaksi
8H+ + WO4– + 6e– → W + 4H2O
Maka nilai kuat arusnya (I)![]()
Jawaban E
Soal No.12
Pada ion S – C ≡ N– , orbital hibrida yang digunakan untuk berikatan oleh atom N adalah …
- sp
- sp2
- sp3
- sp3 d
- sp3 d2
PEMBAHASAN :
Struktur lewis SCN- yaitu:![]()
Atom N memiliki 1 PEB, 1 ikatan σ, 2 ikatan π
Untuk menentukan orbital hibrida cukup menjumlahkan PEB dan ikatan σ = 2
Karena jumlahnya = 2 maka orbital hibridanya = sp
Jawaban A
Semoga Bermanfaat