pembahasan selanjutnya adalah
- laju reaksi,
- konstanta kesetimbangan kimia,
- reaksi reduksi dan oksidasi,
- elektrokimia, serta
- elektrolisis.
Soal No. 31 tentang Laju Reaksi

Laju reaksi yang hanya dipengaruhi oleh suhu adalah ….
A. (1) terhadap (2)
B. (1) terhadap (3)
C. (1) terhadap (5)
D. (2) terhadap (4)
E. (4) terhadap (5)
Pembahasan
Reaksi akan berlangsung lebih cepat apabila tumbukan antarpartikel lebih sering terjadi. Faktor memengaruhi kecepatan reaksi:
- Konsentrasi: semakin besar konsentrasi semakin cepat reaksi berlangsung (membuat minuman dari sirup pekat lebih cepat manis daripada sirup encer).
- Luas Permukaan: semakin besar luas permukaan semakin cepat reaksi berlangsung (membuat minuman dengan gula bubuk lebih cepat manis dari pada gula pasir).
- Suhu: semakin tinggi suhu semakin cepat reaksi berlangsung (membuat teh panas lebih cepat manis daripada membuat es teh).
- Katalis: katalis adalah pemercepat reaksi.
Untuk menentukan laju reaksi yang hanya dipengaruhi suhu pada gambar di atas, carilah dua gambar yang mengalami perubahan suhu tetapi masa dan konsentrasinya tidak mengalami perubahan.
Ya, gambar (1) dan (3). Kedua gambar tersebut mengalami perubahan suhu dari 25 °C menjadi 28 °C. Sementara itu, massanya tidak mengalami perubahan, tetap 1 gram. Demikian juga konsentrasinya, tetap 0,5 M.
Jadi, laju reaksi yang hanya dipengaruhi oleh suhu adalah gambar 1 dan 3 (B).
Perdalam materi ini di Pembahasan Kimia UN: Laju Reaksi.
Soal No. 32 tentang Konstanta Kesetimbangan Kimia
2SO3(g) ⇌ 2SO2(g) + O2(g)
| Keadaan Zat | SO3 (mol) | SO2 (mol) | O2 (mol) |
| Setimbang | 0,2 | 0,2 | 0,1 |
Harga tetapan kesetimbangan (Kc) dari data tersebut adalah ….
A. 10−2
B. 2 × 10−2
C. 5 × 10−2
D. 5 × 10−1
E. 2

Penyelesaian
Harga tetapan kesetimbangan konsentrasi (Kc) adalah perbandingan antara konsentrasi produk pangkat koefisien terhadap konsentrasi reaktan pangkat koefisien.
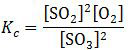
Tabel di atas sangat membantu karena sudah menunjukkan data mol dalam keadaan setimbang. Kita tinggal memanfaatkan data pada tabel untuk dimasukkan langsung pada rumus tetapan kesetimbangan.
Tapi perlu diingat, konsentrasi yang terdapat pada rumus tersebut adalah konsentrasi dalam satuan molar yang ditandai kurung siku. Sedangkan konsentrasi yang terdapat pada tabel masih dalam satuan mol. Jadi, masing-masing harus dibagi volume 2 liter terlebih dahulu.
[SO3] = 0,2 : 2 = 0,1
[SO2] = 0,2 : 2 = 0,1
[O2] = 0,1 : 2 = 0,05
Perlu dicatat, besarnya volume tidak akan memengaruhi perhitungan jika jumlah koefisien ruas kiri sama dengan jumlah koefisien ruas kanan. Hal ini karena perubahan volume pada kondisi tersebut tidak akan memengaruhi pergeseran kesetimbangan.
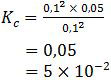
Jadi, harga tetapan kesetimbangan (Kc) dari data tersebut adalah 5 × 10−2 (C).
Perdalam materi ini di Pembahasan Kimia UN: Kesetimbangan Kimia.
Soal No. 33 tentang Reaksi Reduksi dan Oksidasi
Br2 + 2 NaOH → NaBr + NaBrO + H2O
Zat yang mengalami reaksi disproporsionasi (autoredoks) berikut perubahan bilangan oksidasinya adalah ….
A. bromin dari −1 menjadi −2 dan 0
B. bromin dari 0 menjadi −1 dan +1
C. bromin dari 0 menjadi −2 dan
D. natrium dari +1 menjadi −1 dan 0
E. oksigen dari −2 menjadi −3 dan −1
Jawab
Autoredoks atau disproporsionasi adalah reaksi redoks yang terjadi jika suatu unsur mengalami reduksi sekaligus oksidasi. Jadi unsur tersebut bertindak sebagai oksidator dan reduktor.
Mari kita tentukan terlebih dahulu bilangan oksidasi masing-masing unsur selain H dan O. Dalam hal ini, untuk menentukan bilangan oksidasi, nilai koefisien tidak perlu dihitung.

Jadi zat yang mengalami reaksi autoredoks atau disproporsionasi adalah bromin dari 0 menjadi −1 dan +1 (B).
Soal No. 34 tentang Elektrokimia
Mg2+ + 2e → Mg Eo = −2,37 volt
Pb2+ + 2e → Pb Eo = −0,13 volt
Cu2+ + 2e → Cu Eo = +0,34 volt
Mn2+ + 2e → Mn Eo = −1,18 volt
Notasi sel yang menunjukkan reaksi spontan adalah ….
A. Cu | Cu2+ || Mg2+ | Mg
B. Mn | Mn2+ || Mg2+ | Mg
C. Mg | Mg2+ || Pb2+ | Pb
D. Pb | Pb2+ || Mn2+ | Mn
E. Cu | Cu2+ || Pb | Pb2+
Pembahasan
Notasi sel pada reaksi spontan.
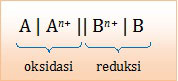
Untuk menerapkan notasi sel tersebut, mari kita urutkan unsur-unsur tersebut dari potensial reduksi terendah sampai tertinggi.
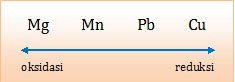
Harga Eo yang lebih kecil akan mengalami oksidasi sebaliknya harga Eo yang lebih besar akan mengalami reduksi. Dengan kata lain:
- Unsur yang letaknya lebih kiri akan mengalami oksidasi, sebaliknya unsur yang letak lebih kanan akan mengalami reduksi.
- Unsur yang letaknya lebih kiri akan berada di sebelah kiri dalam notasi sel, sebaliknya unsur yang letaknya lebih kanan akan berada di sebelah kanan dalam notasi sel.
- Kiri di kiri, kanan di kanan
Mari kita periksa kelima opsi jawaban yang tersedia.
A. Cu | Cu2+ || Mg2+ | Mg (salah, seharusnya Mg sebelah kiri)
B. Mn | Mn2+ || Mg2+ | Mg (salah, seharusnya Mg sebelah kiri)
C. Mg | Mg2+ || Pb2+ | Pb (betul, karena Eo Mg lebih kecil)
D. Pb | Pb2+ || Mn2+ | Mn (salah, seharusnya Mn sebelah kiri)
E. Cu | Cu2+ || Pb | Pb2+ (salah, seharusnya Pb sebelah kiri)
Jadi, notasi sel yang menunjukkan reaksi spontan adalah opsi (C).
Perdalam materi ini di Pembahasan Kimia UN: Reaksi Redoks dan Elektrokimia.
Soal No. 35 tentang Elektrolisis
HF2− → HF + ½ F2 + e
Untuk menghasilkan gas fluorin sebanyak 2,24 liter (STP), muatan listrik yang diperlukan adalah … (1 F = 96.500)
A. 96.500 C
B. 19.300 C
C. 1.930 C
D. 965 C
E. 482,5 C
Penyelesaian
Soal di atas dapat diselesaikan dengan Hukum Faraday I yang dirumuskan:

Karena yang ditanyakan adalah muatan, kita harus memasukkan besaran muatan (Q = i . t) dalam rumus tersebut.
Selain itu, data tentang Ar dan massa (w) dari fluorin tidak disebutkan dalam soal tetapi ada data tentang volume dalam STP. Berarti kita bisa mendapatkan nilai mol dari fluorin. Itu artinya, Ar dan w bisa kita ganti dengan mol (mol = w/Ar).
Dengan demikian diperoleh:
Q = mol . n . 96500
Nilai mol fluorin dapat ditentukan dengan rumus:
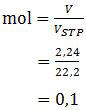
Sedangkan n adalah valensi atau banyaknya mol elektron tiap mol zat. Bingung kan? Artinya begini, n adalah koefisien elektron (e) jika koefisien F2 sama dengan 1. Berarti persamaan di atas harus dijadikan:
2HF2− → 2HF + 1F2 + 2e (diperoleh n = 2)
Sekarang nilai mol dan n sudah kita dapatkan. Tinggal kita masukkan ke dalam rumus:
Q = mol . n . 96500
= 0,1 × 2 × 96500
= 19.300
Jadi, muatan listrik yang diperoleh adalah 19.300 coulomb (B).
Perdalam materi ini di Pembahasan Kimia UN: Sel Elektrolisis dan Hukum Faraday.
Simak Pembahasan Soal Kimia UN 2014 selengkapnya.
Dapatkan pembahasan soal dalam file pdf di sini.
Terimakasih
Semoga Bermanfaat
