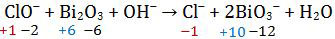pembahasan selanjutnya adalah
Pembahasan soal-soal Ujian Nasional (UN) SMA-IPA bidang studi Kimia dengan materi pembahasan Reaksi Reduksi-Oksidasi dan Elektrokimia.
Soal Reaksi Redoks dan Elektrokimia UN 2013
- C2O42− → 2CO2 + 2e;
- Al3+ + 3e → Al;
- Pb2+ + 2e → Pb; dan
- Ca → Ca2+ + 2e.
Persamaan reaksi reduksi ditunjukkan pada nomor ….
A. (1) dan (3)
B. (1) dan (4)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (4)
Pembahasan
Persamaan reaksi di atas adalah setengah reaksi. Untuk menentukan jenis reaksi reduksi atau oksidasi pada setengah reaksi, cukup dengan memperhatikan letak elektron.
- Jika letak elektron di ruas kiri maka jenis reaksinya adalah reduksi (penangkapan elektron).
- Jika letak elektron di ruas kanan maka jenis reaksinya adalah oksidasi (pelepasan elektron).
Jadi, persamaan reaksi reduksi ditunjukkan oleh nomor 2 dan 3 (C).
Soal Reaksi Redoks dan Elektrokimia UN 2015
Cl2 (g) + 2NaOH (aq) → NaCl (aq) + NaClO (aq) + H2O (l)
Zat yang mengalami reaksi autoredoks beserta perubahan bilangan oksidasinya adalah ….
A. Cl2, dari −1 menjadi +1 dan 0
B. Cl2, dari +1 menjadi −1 dan 0
C. NaOH, dari 0 menjadi −1 dan +1
D. NaOH, dari −1 menjadi +1 dan 0
E. Cl2, dari 0 menjadi −1 dan +1

Pembahasan
Reaksi autoredoks atau disproporsionasi adalah reaksi redoks di mana satu zat mengalami reduksi sekaligus oksidasi.
Mari kita tentukan perubahan bilangan oksidasi pada soal di atas! Kita tentukan bilangan oksidasi atom selain atom H dan O (karena biloks H sudah pasti +1 dan biloks O sudah pasti −2). Berarti tinggal atom Cl dan Na.
Sementara itu, Na adalah atom logam golongan IA di mana bilangan oksidasinya sudah pasti +1. Sehingga kita cukup menentukan perubahan biloks Cl saja.
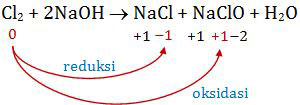
Berdasarkan perubahan biloks di atas, tampak bahwa Cl2 mengalami reaksi reduksi sekaligus reaksi oksidasi. Berarti Cl2 mengalami reaksi autoredoks.
Jadi, zat mengalami reaksi autoredoks adalah Cl2 dengan perubahan bilangan oksidasi dari 0 menjadi −1 dan +1 (E).
Soal Reaksi Redoks dan Elektrokimia UN 2012
a ClO− + Bi2O3 + b OH− → c Cl− + d BiO3− + H2O
Harga koefisien a, b, c, dan d adalah ….
A. 2, 2, 2, dan 3
B. 3, 3, 3, dan 2
C. 2, 1, 2, dan 2
D. 2, 2, 2, dan 2
E. 2, 2, 1, dan 2
Pembahasan
Langkah-langkah untuk menyetarakan persamaan reaksi redoks pada soal di atas adalah sebagai berikut:
- Menyetarakan jumlah atom selain atom H dan O, yaitu Cl dan Bi. Atom Cl di ruas kiri dan kanan sudah setara sedangkan atom Bi pada ruas kanan harus dikalikan 2.
ClO− + Bi2O3 + OH− → Cl− + 2BiO3− + H2O
- Menentukan bilangan oksidasi total untuk atom Cl dan Bi (koefisien dan jumlah atom ikut dihitung). Ingat, biloks H = +1 dan biloks O = −2.
- Menentukan perubahan biloks Cl dan Bi serta perbandingan terkecilnya.
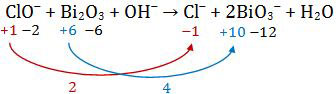
Perbandingan perubahan biloks terkecil = 2 : 4 = 1 : 2
- Mengalikan silang perubahan biloks. Perubahan biloks Cl dikalikan pada senyawa Bi dan sebaliknya.
2ClO− + Bi2O3 + OH− → 2Cl− + 2BiO3− + H2O
- Menentukan dan menyetarakan jumlah muatan ruas kiri dan ruas kanan.
Karena jumlah muatan ruas kiri −3 dan muatan ruas kanan −4, maka ruas kanan harus ditambahkan OH− supaya kedua ruas bermuatan −4 sehingga menjadi 2OH−. Persamaan reaksi setaranya adalah:
2ClO− + Bi2O3 + 2OH− → 2Cl− + 2BiO3− + H2O
Jadi, harga koefisien a, b, c, dan d yang benar adalah opsi (D).
Soal Reaksi Redoks dan Elektrokimia UN 2014
Cr3+ (aq) + 3e → Cr (s) Eo = −0,71 volt
Ag+ (aq) + e → Ag (s) Eo = +0,80 volt
Al3+ (aq) + 3e → Al (s) Eo = −1,66 volt
Zn2+ (aq) + 2e → Zn (s) Eo = −0,74 volt
Notasi sel yang dapat berlangsung spontan adalah ….
A. Ag/Ag+//Cr3+/Cr
B. Ag/Ag+//Zn2+/Zn
C. Cr/Cr3+//Al3+/Al
D. Zn/Zn2+//Al3+/Al
E. Zn/Zn2+//Ag+/Ag
Pembahasan
Langkah pertama untuk menyelesaikan soal di atas adalah mengurutkan atom berdasarkan potensial elektroda standar dari yang terkecil sampai terbesar.
Al, Zn, Cr, Ag
Berdasarkan urutan tersebut, atom yang letaknya lebih kiri (potensial reduksi lebih kecil) akan mengalami oksidasi sedangkan yang lebih kanan (potensial reduksi lebih besar) akan mengalami reduksi.
Mari kita perhatikan bentuk umum notasi sel yang berlangsung spontan.
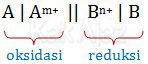
Nah, sekarang kita periksa setiap opsi jawaban berdasarkan bentuk umum notasi sel dan urutan potensial reduksi standar.
Cr lebih kiri daripada Ag, seharusnya Cr mengalami oksidasi [opsi A salah]
Zn lebih kiri daripada Ag, seharusnya Zn mengalami oksidasi [opsi B salah]
Al lebih kiri daripada Cr, seharusnya Al mengalami oksidasi [opsi C salah]
Al lebih kiri daripada Zn, seharusnya Al mengalami oksidasi [opsi D salah]
Zn lebih kiri daripada Ag, sehingga Zn mengalami oksidasi dan Ag mengalami reduksi [opsi E benar]
Jadi, notasi sel yang berlangsung spontan adalah opsi (E).
Soal Reaksi Redoks dan Elektrokimia UN 2015
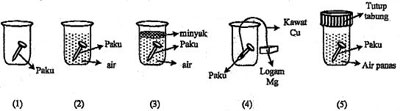
Paku yang mengalami perkaratan paling lambat adalah ….
A. (1)
B. (2)
C. (3)
D. (4)
E. (5)
Pembahasan
Di antara faktor yang memengaruhi korosi paku (besi) adalah sebagai berikut:
- besi berada pada medium yang mengandung O2 dan H2O,
- besi bersentuhan dengan larutan asam atau garam,
- besi berhubungan dengan logam lain, dan
- temperatur.
Sekarang mari kita periksa masing-masing gambar di atas.
- Gambar (1) paku hanya berhubungan dengan udara (O2) sehingga paku sangat lambat mengalami korosi.
- Gambar (2) paku berada dalam air (H2O) dengan wadah terbuka sehingga memungkinkan O2 masuk [cepat korosi]
- Gambar (3) paku berada dalam air dan minyak dengan wadah yang terbuka sehingga masih memungkinkan O2 masuk [mudah korosi]
- Gambar (4) paku dihubungkan logam Mg yang menurut deret Volta terletak di sebelah kiri besi (Fe). Keadaan ini membuat paku lebih aman korosi karena Mg akan terserang korosi terlebih dahulu. Tetapi karena penghubungnya kawat Cu yang menurut deret Volta terletak di sebelah kanan Fe, maka paku akan terserang korosi lebih dahulu [cepat korosi]
Deret Volta: K, Ba, Ca, Na, Mg, Al, Mn. Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au
- Gambar (5) paku berada dalam air panas dengan wadah tertutup. Meskipun tertutup tetapi di dalam wadah masih tersisa O2 sehingga masih memungkinkan mengalami korosi, apalagi air yang digunakan adalah air panas.
Jadi, paku yang mengalami perkaratan paling lambat ditunjukkan oleh nomor 1 (A).
Pembahasan soal Reaksi Redoks dan Elektrokimia yang lain bisa dilihat di:
Pembahasan Kimia UN 2014 No. 33 dan 34
Pembahasan Kimia UN 2015 No. 34 dan 35
Pembahasan Kimia UN 2015 No. 36
Pembahasan Kimia UN 2016 No. 17
Pembahasan Kimia UN 2016 No. 30
Pembahasan Kimia UN 2016 No. 31 – 33
Pembahasan Kimia UN 2017 No. 9 dan 10
Pembahasan Kimia UN 2017 No. 33
Pembahasan Kimia UN 2018 No. 20
Pembahasan Kimia UN 2018 No. 22
Pembahasan Kimia UN 2019 No. 24 dan 25
Simak juga:
Pembahasan Kimia UN: Sel Elektrolisis dan Hukum Faraday
Pembahasan Kimia UN: Korosi
Dapatkan pembahasan soal dalam file pdf di sini.
Terimakasih
Semoga Bermanfaat