pembahasan selanjutnya adalah
Soal Laju Reaksi UN 2014 (1)
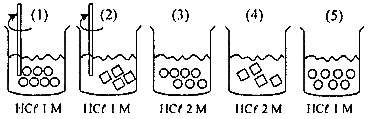
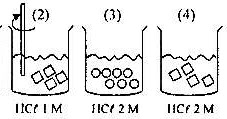
Laju reaksi yang hanya dipengaruhi luas permukaan terdapat pada gambar nomor ….
A. (1) terhadap (2)
B. (2) terhadap (3)
C. (2) terhadap (4)
D. (3) terhadap (5)
E. (4) terhadap (5)
Pembahasan
Mari kita periksa setiap opsi jawaban.
- Opsi A, (1) terhadap (2):
sama-sama diaduk dan konsentrasinya sama, yang membedakan adalah bentuk dan jumlah kristal CaCO3 (luas permukaan), berarti yang memengaruhi laju reaksinya hanyalah luas permukaan.
- Opsi B, (2) terhadap (3):
nomor (2) dilakukan pengadukan sedangkan nomor (3) tidak, konsentrasi dan luas permukaan berbeda, sehingga yang memengaruhi adalah pengadukan, konsentrasi, dan luas permukaan.
- Opsi C, (2) terhadap (4):
nomor (2) dilakukan pengadukan dan nomor (4) tidak, konsentrasi berbeda, dan luas permukaan sama sehingga yang memengaruhi laju reaksi adalah pengadukan dan konsentrasi.
- Opsi (D), (3) terhadap (5):
Konsentrasi berbeda dan luas permukaan sama berarti yang memengaruhi laju reaksi hanyalah konsentrasi.
- Opsi (E), (4) terhadap (5):
Konsentrasi dan luas permukaan berbeda sehingga yang memengaruhi laju reaksi adalah konsentrasi dan luas permukaan.
Jadi, laju reaksi yang hanya dipengaruhi luas permukaan terdapat pada gambar nomor 1 dan 2 (A).
Soal Laju Reaksi UN 2013
Zn (s) + 2HCl (aq) → ZnCl2 (aq) + H2 (g)
| Waktu (detik) | 10 | 20 | 30 |
| Volume gas H2 (mL) | 80 | 200 | 320 |
Laju pembentukan gas H2 rata-rata pada suhu tersebut adalah ….
A. 8,0 mL/detik
B. 10,5 mL/detik
C. 11,0 mL/detik
D. 11,5 mL/detik
E. 12,0 mL/detik

Pembahasan
Laju reaksi dalam satuan volume per waktu dirumuskan sebagai:
Untuk mengetahui laju rata-rata pembentukan gas hidrogen, kita tentukan laju reaksi dalam selang waktu yang sama, misal dalam selang waktu 10 detik.
Laju reaksi dalam selang waktu 10 – 20 detik
= 120/10
= 12
Laju reaksi dalam selang waktu 20 – 30 detik
= 120/10
= 12
Jadi, laju pembentukan gas hidrogen rata-rata pada suhu tersebut adalah 12,0 mL/detik (E).
Soal Laju Reaksi UN 2014 (2)
Mg (s) + 2HCl (aq) → MgCl2 (aq) + H2 (g)
sehingga diperoleh data sebagai berikut:
| No. | Suhu (°C) | Waktu (detik) | Volume gas H2 yang terjadi (cm3) |
| 1. 2. 3. |
27 27 27 |
10 20 |
14 25 |
Jika reaksi dilakukan pada suhu 27 °C maka besarnya laju reaksi pembentukan gas tersebut selama 20 detik adalah ….
A. 1,10 cm3/det
B. 1,25 cm3/det
C. 1,40 cm3/det
D. 1,80 cm3/det
E. 2,50 cm3/det
Pembahasan
Laju reaksi pembentukan gas hidrogen selama 20 detik berarti laju reaksi dari detik ke-0 sampai detik ke-20.
= 1,25
Jadi, besarnya laju reaksi pembentukan gas hidrogen selama 20 detik adalah 1,25 cm3/detik (B).
Soal Laju Reaksi UN 2012
2NO(g) + Br2(g) → 2NOBr(g)
| No. | Konsentrasi Awal | Laju Reaksi (M/s) | |
| [NO] (M) | [Br2] (M) | ||
| 1 2 3 4 |
0,10 0,10 0,20 0,30 |
0,15 0,30 0,30 0,45 |
12 × 10−2 24 × 10−2 96 × 10−2 48 × 10−2 |
Berdasarkan data di atas, orde reaksi total adalah ….
A. 0
B. 1
C. 2
D. 3
E. 4
Pembahasan
Untuk menentukan orde reaksi [NO], kita berpedoman pada konsentrasi [Br2] yang tetap, yaitu nomor 2 dan 3. Kemudian kita bandingkan konsentrasi [NO] nomor 2 dan 3 terhadap laju reaksinya.
2m = 4
m =2
Sedangkan orde reaksi [Br2] ditentukan dengan berpedoman pada konsentrasi [NO] yang tetap, yaitu nomor 1 dan 2.
2n = 2
n = 1
Orde reaksi total adalah jumlah orde reaksi [NO] dan orde reaksi [Br2].
m + n = 2 + 1
= 3
Jadi, orde reaksi totalnya adalah 3 (D).
Soal Laju Reaksi UN 2011
| No. | [Q] | [T] | v (M/det) |
| 1 2 3 |
0,1 0,2 0,1 |
0,1 0,1 0,2 |
1,25 × 10−2 5 × 10−2 10−1 |
Jika [Q] dan [T] masing-masing diubah menjadi 0,5 M maka harga laju reaksi (v) saat itu adalah … M/det.
A. 5,0
B. 7,5
C. 10,5
D. 12,5
E. 39,0
Pembahasan
Kita tentukan dulu orde reaksi dari [Q] dan [T]. Orde reaksi [Q] dapat ditentukan saat [T] tetap, yaitu nomor 1 dan 2.
2m = 4
m = 2
Orde reaksi [T] dapat ditentukan saat [Q] tetap, yaitu nomor 1 dan 3.
2n = 8
n = 3
Dengan demikian persamaan laju reaksinya adalah
v = k[Q]2[T]3
Dengan berpedoman pada tabel nomor 1, jika [Q] dan [T] masing-masing diubah menjadi 0,5 M berarti masing-masing dijadikan 5 kali semula.
v‘ = k[5Q]2[5T]3
= 55k[Q]2[T]3
= 3125 v
= 3125 × 1,25 × 10−2
= 39
Jadi, harga laju reaksi saat [Q] dan [T] masing-masing diubah menjadi 0,5 M adalah 39,0 M/det (E).
Pembahasan soal Laju Reaksi lainnya bisa dilihat di:
Pembahasan Kimia UN 2014 No. 29
Pembahasan Kimia UN 2014 No. 31
Pembahasan Kimia UN 2015 No. 28 dan 30
Pembahasan Kimia UN 2016 No. 23 dan 24
Pembahasan Kimia UN 2018 No. 15
Pembahasan Kimia UN 2018 No. 16
Pembahasan Kimia UN 2019 No. 17 dan 20
Simak juga, Pembahasan Kimia UN: Kesetimbangan Kimia.
Dapatkan pembahasan soal dalam file pdf di sini.
Terimakasih
Semoga Bermanfaat