pembahasan selanjutnya adalah

Pembahasan soal Kimia Ujian Nasional (UN) tahun 2019 nomor 6 sampai dengan nomor 10 tentang:
- stoikiometri larutan [persen massa],
- stoikiometri [pereaksi pembatas],
- stoikiometri larutan,
- kelimpahan unsur di alam, serta
- kelimpahan unsur di alam dan pengolahannya.
Soal No. 6 tentang Stoikiometri Larutan [persen massa]
A. 39,69%
B. 53,86%
C. 58,36%
D. 63,00%
E. 81,60%
Pembahasan
Diketahui:
Larutan asam nitrat
Mr = 63
M = 16,43 M
ρ = 1,643 g/mL
= 1643 g/L
Kadar asam nitrat dalam % massa dapat diperoleh dari rumus:
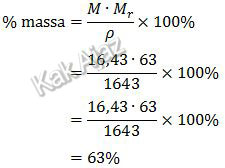
Jadi, kadar asam nitrat dalam larutan tersebut adalah 63,00% (D).
Perdalam materi ini di:
Hubungan Persen Massa dan Molaritas
Pembahasan Kimia UN: Stoikiometri Larutan
Soal No. 7 tentang Stoikiometri [pereaksi pembatas]
Produksi industri amonium nitrat secara sederhana sebagai berikut:
HNO3(aq) + NH3(g) → NH4NO3(s)
Reaksi antara 12,6 gram asam nitrat dan 2,24 L gas amoniak pada STP menghasilkan massa padatan NH4NO3 sebesar … (Ar N = 14, H = 1, O = 16).
A. 0,4 gram
B. 0,8 gram
C. 4 gram
D. 8 gram
E. 16 gram
Pembahasan
Reaksi di atas sudah setara. Sekarang kita tentukan jumlah mol tiap pereaksi.
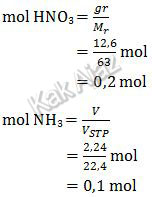
Berdasarkan kedua nilai mol di atas, kita gunakan mol NH3 sebagai pereaksi pembatas (karena nilai molnya lebih kecil).
mol NH4NO3 = mol NH3[koefisien sama]
= 0,1 mol
gr NH4NO3 = mol × Mr
= 0,1×80 gram
= 8 gram
Jadi, massa padatan NH4NO3 yang dihasilkan adalah 8 gram (D).
Perdalam materi ini di Pembahasan Kimia UN: Stoikiometri Larutan.
Soal No. 8 tentang Stoikiometri Larutan
A. 7,9 ∙ 10−4 M
B. 8,7 ∙ 10−4 M
C. 79 ∙ 10−2 M
D. 87 ∙ 10−2 M
E. 1 ∙ 102 M

Pembahasan
Diketahui:
% massa = 10%
= 0,1
ρ = 1 g/mL
=1000 g/L
Mr = 127
Soal ini mirip dengan soal nomor 6.

Catatan: 100% = 100/100 = 1 (dalam hal ini tidak perlu diikutkan)
Jadi, konsentrasi iodin tersebut adalah 79 ∙ 10−2 M (C).
Perdalam materi ini di:
Hubungan Persen Massa dan Molaritas
Pembahasan Kimia UN: Stoikiometri Larutan
Soal No. 9 tentang Kelimpahan Unsur di Alam
| No | Mineral | Unsur |
| (1) | siderit | besi |
| (2) | barite | tembaga |
| (3) | kalkosit | tembaga |
| (4) | kriolit | belerang |
| (5) | pirit | karbon |
Pasangan data yang tepat antara mineral dan kandungan unsurnya adalah ….
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (3) dan (4)
E. (4) dan (5)
Pembahasan
Berikut ini tabel hubungan antara mineral dan unsur yang dikandungnya.
| Unsur | Mineral |
| besi | hematit, magnetit, pirit, siderit, limonit |
| tembaga | kalkopirit, kalkosit |
| belerang | barite, gipsum |
| karbon | arang, kokas, batu bara |
Jadi, pasangan data yang tepat antara mineral dan kandungan unsurnya adalah nomor 1 dan 3 (B).
Perdalam materi ini di Pembahasan Kimia UN: Kelimpahan Unsur di Alam.
Soal No. 10 tentang Kelimpahan Unsur di Alam dan Pengolahannya
Berikut beberapa pernyataan yang berkaitan dengan proses pembuatan logam besi.
- Reaksi berlangsung pada suhu 900 ℃.
- Kokas berfungsi sebagai oksidator.
- Batu kapur berfungsi sebagai fluks.
- Proses berlangsung pada tanur tinggi.
Pasangan pernyataan yang benar berkaitan dengan pengolahan besi tersebut adalah ….
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (4)
Pembahasan
Beberapa hal yang berkaitan dengan proses pengolahan besi antara lain:
- proses berlangsung pada tanur tinggi [pernyataan 4 benar]
- reaksi endoterm berlangsung pada suhu 1300 ℃ sedangkan reaksi eksoterm berlangsung pada suhu 1900 ℃ [pernyataan 1 salah]
- batu kapur digunakan sebagai fluks, yaitu mengikat pengotor pada bijih besi [pernyataan 3 benar]
- kokas berfungsi sebagai reduktor [pernyataan 2 salah]
Jadi, pasangan pernyataan yang benar berkaitan dengan pengolahan besi tersebut adalah pernyataan 3 dan 4 (E).
Perdalam materi ini di Pembahasan Kimia UN: Kelimpahan Unsur di Alam
Simak Pembahasan Soal Kimia UN 2019 selengkapnya.
Dapatkan pembahasan soal dalam file pdf di sini.
Terimakasih
Semoga Bermanfaat
