pembahasan selanjutnya adalah

Pembahasan soal Kimia Ujian Nasional (UN) tahun 2019 nomor 21 sampai dengan nomor 25 tentang:
- sifat koligatif larutan [kenaikan titik didih],
- sifat koligatif larutan,
- sifat koligatif larutan elektrolit,
- bilangan oksidasi, serta
- reaksi reduksi dan oksidasi.
Soal No. 21 tentang Sifat Koligatif Larutan [kenaikan titik didih]
A. 5,6 gram
B. 11,2 gram
C. 22,5 gram
D. 45,0 gram
E. 67,5 gram
Pembahasan
Diketahui:
Mr = 180
gr = 100 gram
p = 100
Kb = 0,52 ℃.Kg/mol
∆tb = 100,65 ℃-100 ℃
= 0,65 ℃
Massa glukosa bisa dicari dari rumus kenaikan titik didih berikut:

Jadi, massa glukosa yang dilarutkan adalah 22,5 gram (C).
Perdalam materi ini di Pembahasan Kimia UN: Sifat Koligatif Larutan.
Soal No. 22 tentang Sifat koligatif Larutan

Jika Mr NaCl = 58,5, Mr glukosa = 180 dan tb air = 100 ℃, tetapan kenaikan titik didih molal air dalam larutan glukosa dan NaCl adalah ….
A. 0,52 ℃/mol
B. 0,54 ℃/mol
C. 0,55 ℃/mol
D. 0,56 ℃/mol
E. 0,57 ℃/mol
Pembahasan
Berdasarkan data dan keterangan pada gambar, diperoleh:
Untuk larutan glukosa
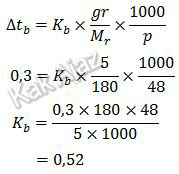
Untuk larutan garam NaCl

Jadi, tetapan kenaikan titik didih molal air dalam larutan glukosa dan NaCl adalah 0,52 ℃/mol (A).
Perdalam materi ini di Pembahasan Kimia UN: Sifat Koligatif Larutan.
Soal No. 23 tentang Sifat Koligatif Larutan Elektrolit
- Kalsium karbonat.
- Barium klorida.
- Besi (III) klorida
- Aluminium sulfat
- Kalium nitrat
Larutan gram yang mempunyai titik beku paling rendah adalah ….
A. (1)
B. (2)
C. (3)
D. (4)
E. (5)

Pembahasan
Karena konsentrasinya sama, titik beku hanya bergantung pada jumlah partikel (ion). Dalam hal ini i = n.
| Kalsium karbonat | : | CaCO3 | i = 2 |
| Barium klorida | : | BaCl2 | i = 3 |
| Besi (III) klorida | : | FeCl3 | i = 4 |
| Aluminium sulfat | : | Al2(SO4)3 | i = 5 |
| Kalium nitrat | : | KNO3 | i = 2 |
Berdasarkan rumus penurunan titik beku:

Bila nilai i besar maka nilai ∆tf ikut besar.
Sedangkan berdasarkan rumus:
∆tf = 0 − tf
Bila nilai ∆tf besar maka nilai tf juga ikut besar tetapi bertanda negatif. Dengan kata lain, bila ∆tf besar maka tf rendah.
Jadi, larutan gram yang mempunyai titik beku paling rendah adalah aluminium sulfat (D).
Perdalam materi ini di Pembahasan Kimia UN: Sifat Koligatif Larutan.
Soal No. 24 tentang Bilangan Oksidasi
A. −4 dan +4
B. −2 dan +2
C. +2 dan +3
D. +4 dan +2
E. +6 dan +4
Pembahasan
Aluminium (Al) adalah golongan IIIA sehingga bilangan oksidasinya = +3.
Al2(SO4)3 → 2Al3+ + 3SO42−
Bilangan oksidasi S kiat cari dari ion SO42− saja supaya lebih angkanya sederhana.
SO42− = S + 4(−2) [biloks O = −2]
−2 = S − 8
S = +6
Selanjutnya kita cari biloks dari SO32−.
SO32− = S + 3(−2)
−2 = S − 6
S = +4
Jadi, bilangan oksidasi belerang dalam aluminium sulfat Al2(SO4)3 dan ion SO32− berturut-turut adalah +6 dan +4 (E).
Perdalam materi ini di Pembahasan Kimia UN: Reaksi Reduksi dan Oksidasi.
Soal No. 25 tentang Reaksi Reduksi dan Oksidasi
Cd(s) + NiO2(aq) + 2H2O(l) ⇌ Cd(OH)2(s) + Ni(OH)2(s)
Spesi kimia yang bertindak sebagai reduktor pada saat baterai digunakan adalah ….
A. Cd, karena mengalami kenaikan bilangan oksidasi
B. NiO2, karena mengalami kenaikan bilangan oksidasi
C. H2O, karena mengalami kenaikan bilangan oksidasi
D. Cd, karena mengalami penurunan bilangan oksidasi
E. NiO2, karena mengalami penurunan bilangan oksidasi
Pembahasan
Perhatikan perubahan biloks di bawah ini!

Berdasarkan gambar di atas dapat disimpulkan bahwa Cd bertindak sebagai reduktor karena mengalami kenaikan biloks. Sedangkan NiO2 bertindak sebagai oksidator karena mengalami peranan biloks.
Jadi, spesi kimia yang bertindak sebagai reduktor pada saat baterai digunakan adalah Cd, karena mengalami kenaikan bilangan oksidasi (A).
Perdalam materi ini di Pembahasan Kimia UN: Reaksi Reduksi dan Oksidasi.
Simak Pembahasan Soal Kimia UN 2019 selengkapnya.
Dapatkan pembahasan soal dalam file pdf di sini.
Terimakasih
Semoga Bermanfaat
