pembahasan selanjutnya adalah

Pembahasan soal Kimia Ujian Nasional (UN) tahun 2018 nomor 26 sampai dengan nomor 30 tentang:
- termokimia [energetika],
- hukum Faraday,
- stoikiometri,
- termokimia, dan
- korosi.
Soal No. 26 tentang Termokimia [energi ikat]
H – H : 435 kJ/mol
N ≡ N : 946 kJ/mol
N – H : 390 kJ.mol
Kalor yang diperlukan untuk menguraikan 1,7 gram gas amoniak (Ar N = 14 g/mol; H = 1 g/mol) menjadi unsur-unsurnya adalah ….
A. 4,45 kJ
B. 8,9 kJ
C. 108,1 kJ
D. 1081 kJ
E. 1170 kJ
Pembahasan
Reaksi penguraian amoniak adalah:
NH3 → 1/2 N2 + 3/2 H2
atau
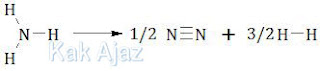
Kalor yang diperlukan untuk reaksi di atas adalah:
∆Hreaksi = energi ruas kiri − energi ruas kanan
= 3(N-H) – 1/2(N≡N) – 3/2(H-H)
= 3×390 − 1/2×946 − 3/2×435
= 1170 − 473 − 652,5
= 44,5
Energi tersebut adalah energi penguraian 1 mol NH3. Sedangkan pada soal, tersedia 1,7 gram NH3 (Mr = 17). Oleh karena itu, kita cari mol NH3 dulu.
mol NH3 = (gr NH3)/(Mr NH3)
= 1,7/17
= 0,1 mol
Dengan demikian, kalor yang diperlukan pada penguraian 1,7 gram NH3 adalah:
0,1 × 44,5 = 4,45
Jadi, kalor yang diperlukan untuk menguraikan gas amoniak tersebut adalah 4,45 kJ (A).
Perdalam materi ini di Pembahasan Kimia UN: Termokimia
Soal No. 27 tentang Hukum Faraday
Kunci yang terbuat dari besi akan disepuh dengan logam emas menggunakan kuat arus 10 ampere selama 9650 detik, seperti gambar berikut.
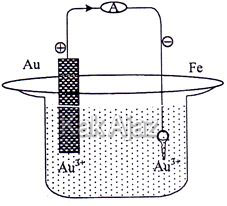
Pada reaksi penyepuhan kunci besi dengan logam emas diperlukan arus listrik 0,015 Faraday, massa logam emas yang melapisi kunci besi tersebut adalah … (Ar Au = 197 g/mol).
A. 0,0985 gram
B. 0,2985 gram
C. 0,9850 gram
D. 2,9850 gram
E. 9,050 gram

Pembahasan
Proses penyepuhan kunci besi dengan logam emas terjadi di katoda dengan reaksi:
Au3+ + 3e → Au
Diketahui:
n = 3
i∙t = 0,015 F
= 0,015 × 96500
Massa Au yang mengendap pada katoda (anak kunci) tersebut adalah:
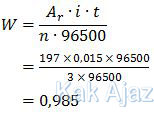
Jadi, massa logam emas yang melapisi kunci besi tersebut adalah 0,9850 gram (C).
Perdalam materi ini di Pembahasan Kimia UN: Elektrolisis dan Hukum Faraday
Soal No. 28 tentang Stoikiometri

Berdasarkan wacana tersebut, untuk menghitung kadar NaClO dalam pemutih digunakan titrasi iodometri dengan Na2S2O3 sebagai larutan standar. Jika 20 mL NaClO dititrasi memerlukan 15 mL Na2S2O3 0,1 M maka kadar NaClO (w/w) dalam pemutih tersebut adalah ….
(Mr NaClO = 74,5; ρ NaClO = 1 g/mL)
A. 0,279%
B. 0,558%
C. 1,116%
D. 2,232%
E. 4,464%
Pembahasan
Perhatikan dua reaksi berikut ini!
- NaClO + 2KI + 2HCl → NaCl + 2KCl + I2 + H2O
- I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Data yang dapat digunakan untuk menghitung mol adalah data Na2S2O3 pada reaksi (2).
mol Na2S2O3 = MV
= 0,1 × 15 mmol
= 1,5 mmol
Yang menjadi jembatan penghubung reaksi (1) dan (2) adalah I2. Koefisien I2 pada kedua reaksi adalah sama, yaitu 1. Sedangkan koefisien NaClO juga 1. Sehingga kita dapat menentukan mol NaClO berdasarkan perbandingan koefisien.
mol NaClO = 1/2 × mol Na2S2O3
= 1/2 × 1,5 mmol
= 0,75 mmol
Sehingga massa NaClO adalah:
gr NaClO = mol × Mr
= 0,75 mmol × 74,5 g/mol
= 55,875 mg
= 0,055875 g
Sementara itu, massa NaClO sebelum titrasi adalah:
m NaClO = ρV
= 1 gr/mL × 20 mL
= 20 gr
Dengan demikian, kadar NaClO adalah:
%NaClO = 0,055875/20 × 100%
= 0,279%
Jadi, kadar NaClO dalam pemutih tersebut adalah 0,279% (A).
Perdalam materi ini di Pembahasan Kimia UN: Stoikiometri Larutan
Soal No. 29 tentang Termokimia
∆Hf CO2(g) = −394 kJ/mol
∆Hf H2O (g) = −286 kJ/mol
∆Hf C2H5OH(g) = −266 kJ/mol
Entalpi pembakaran standar dari pembakaran etanol menurut reaksi:
C2H5OH(g) + 3O2(g) → 2CO2(g) + 3H2O(g)
adalah ….
A. −1094 kJ/mol
B. −1380 kJ/mol
C. −1488 kJ/mol
D. −2986 kJ/mol
E. −2020 kJ/mol
Pembahasan
Entalpi pembakaran standar etanol menurut reaksi tersebut dirumuskan:
∆Hreaksi = ∆Hhasil – ∆Hpereaksi
= 2∆Hf CO2 +3∆Hf H2O − ∆Hf C2H5OH
= 2×(−394) + 3×(−286) − (−266)
= −788 − 858 + 266
= −1380
Jadi, entalpi pembakaran standar etanol adalah −1380 kJ/mol (B).
Perdalam materi ini di Pembahasan Kimia UN: Termokimia
Soal No. 30 tentang Korosi
Seorang siswa melakukan percobaan menyelidiki faktor-faktor penyebab korosi pada besi. Bahan besi yang digunakan adalah paku yang telah diamplas. Diagram percobaan yang dilakukan adalah sebagai berikut:

Keterangan:
- Indikator fenolftalein membentuk warna merah muda jika terdapat ion OH−.
- CaCl2 anhidrat merupakan zat yang higroskopis (menyerap air) sehingga udara dalam tabung bebas uap air.
- Air yang sudah dididihkan kehilangan oksigen terlarut.
- K3Fe(CN)6 membentuk kompleks warna biru jika terdapat ion Fe2+.
Setelah 2 hari kemudian diperoleh data sebagai berikut:

Berdasarkan percobaan tersebut, faktor penyebab terjadinya korosi besi adalah ….
A. besi memiliki kemampuan mengalami reduksi > dari Zn
B. adanya ion OH− (suasana basa) di sekitar besi
C. E reduksi besi < E reduksi air
D. besi merupakan oksidator kuat
E. adanya gas oksigen dan uap air di sekitar besi
Pembahasan
Mari kita ulas satu per satu dari keenam tabung di atas!
- Tabung (1): paku berkarat karena terdapat udara (O2) dan air.
- Tabung (2): paku tidak berkarat karena tabung tertutup dan berisi air penuh (tidak terdapat udara), apalagi air yang digunakan adalah air yang sudah dididihkan sehingga kehilangan oksigen terlarut.
- Tabung (3): paku tidak berkarat karena dalam tabung hanya terdapat udara kering tanpa air, kandungan air sudah diserap oleh CaCl2.
- Tabung (4): paku tidak berkarat karena berada dalam media minyak sehingga bebas dari air.
- Tabung (5): paku berkarat karena dihubungkan dengan logam Sn yang potensial reduksi lebih besar atau letaknya lebih kanan dalam deret Volta.
- Tabung (6): paku tidak berkarat dihubungkan dengan logam Cr yang potensial reduksi lebih kecil atau letaknya lebih kiri dalam deret Volta.
Deret Volta:
K-Ba-Ca-Na-Mg-Al-Mn-Zn-Cr-Fe-Ni-Sn-Pb-H-Cu-Hg-Ag-Pt-Au
Jadi, faktor penyebab terjadinya korosi besi adalah adanya gas oksigen dan uap air di sekitar besi (E).
Perdalam materi ini di Pembahasan Kimia UN: Reaksi Redoks dan Elektrokimia
Simak Pembahasan Soal Kimia UN 2018 selengkapnya.
Dapatkan pembahasan soal dalam file pdf di sini.
Terimakasih
Semoga Bermanfaat
