pembahasan selanjutnya adalah

Pembahasan soal Kimia Ujian Nasional (UN) tahun 2018 nomor 21 sampai dengan nomor 25 tentang:
- penerapan elektrolisis,
- sel elektrokimia,
- elektrolisis,
- sifat koligatif larutan, serta
- sifat koligatif larutan elektrolit dan nonelektrolit.
Soal No. 21 tentang Penerapan Elektrolisis
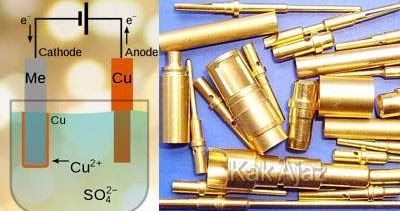
Sendok logam yang terbuat dari zink akan disepuh dengan logam tembaga.

Reaksi yang terjadi di katoda adalah ….
A. Cu2+(aq) + Zn(s) → Cu(s) + Zn2+
B. Zn(s) → Zn2+(aq) + 2e
C. Zn2+(aq) + 2e → Zn(s)
D. Cu(s) → Cu2+(aq) + 2e
E. Cu2+(aq) + 2e → Cu(s)
Pembahasan
Pada gambar di atas terlihat bahwa:
- Anoda : logam tembaga (Cu)
- Katoda : logam seng (Zn)
Perhatikan, anodanya adalah elektroda aktif, yaitu Cu (selain Pt/C). Elektroda ini akan mengalami oksidasi di anoda.
Sedangkan reaksi di katoda bergantung pada kation larutan, yaitu Cu2+. Kation ini akan mengalami reduksi di katoda.
- Anoda : Cu(s) → Cu2+(aq) + 2e
- Katoda : Cu2+(aq) + 2e → Cu(s)
Tampak bahwa tembaga (Cu) mengendap pada katoda (Zn) sehingga tembaga akan melapisi sendok seng.
Jadi, reaksi yang terjadi di katoda adalah opsi (E).
Perdalam materi ini di Pembahasan Kimia UN: Elektrolisis dan Hukum Faraday
Soal No. 22 tentang Sel Elektrokimia
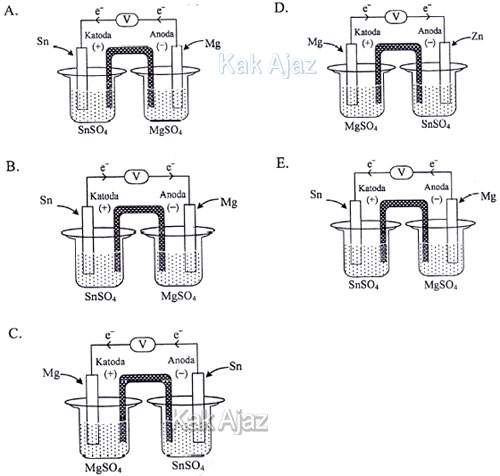
Gambar sel volta berdasarkan notasi sel tersebut adalah ….

Pembahasan
Perhatikan notasi sel volta berikut ini!

Di anoda, Mg mengalami oksidasi menjadi Mg2+ dengan melepas elektron. Kemudian Mg2+ masuk ke dalam larutan sedangkan elektron mengalir melalui kawat menuju katoda. Sesampai di katoda, elektron tersebut ditangkap oleh Sn2+ sehingga mengalami reduksi menjadi Sn.
Dengan demikian,
- anoda : Mg
- katoda : Sn
- arah elektron : dari anoda ke katoda
Jadi, gambar sel volta yang benar adalah (A/E).
Perdalam materi ini di Pembahasan Kimia UN: Reaksi Redoks dan Elektrokimia
Soal No. 23 tentang Elektrolisis
Katoda (−) : Ni2+(aq) + 2e → Ni(s)
Anoda (+) : 2H2O(l) → O2(g) + 4H+(aq) + 4e
⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯
Reaksi sel : Ni2+(aq) + 2H2O(l) → O2(g) + 4H+(aq) + Ni(s)
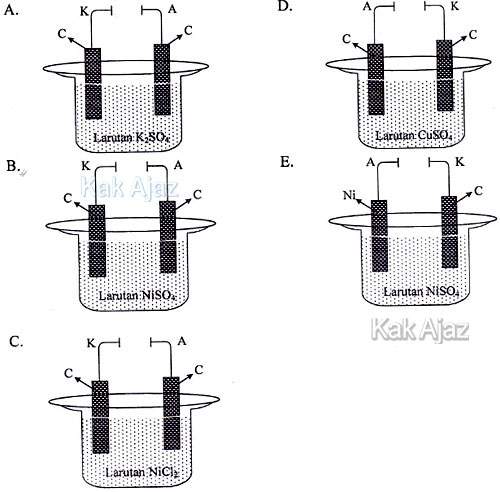
Gambar yang tepat untuk peristiwa elektrolisis tersebut adalah ….
Pembahasan
Mari kita perhatikan reaksi yang terjadi di katoda dan anoda!
- Di katoda terjadi endapan Ni, berarti larutan mengandung kation Ni2+.
- Di anoda terjadi oksidasi air, berarti anion mengandung unsur O serta elektroda yang digunakan bukan elektroda aktif.
Berdasarkan opsi yang ada, larutan yang digunakan adalah NiSO4 (opsi B dan E). Hanya saja opsi E menggunakan elektroda aktif (selain Pt/C) pada anodanya.
Jadi, gambar yang tepat untuk peristiwa elektrolisis tersebut adalah opsi (B).
Perdalam materi ini di Pembahasan Kimia UN: Elektrolisis dan Hukum Faraday
Soal No. 24 tentang Sifat Koligatif Larutan
A. 0,031 ℃/m
B. 0,520 ℃/m
C. 0,604 ℃/m
D. 1,86 ℃/m
E. 3,72 ℃/m
Pembahasan
Diketahui:
Data-data urea (CO(NH2)2)
Mr = 60
gr = 11,7 g
p = 1 L = 1000 g
∆Tf = 0 – (–0,367) = 0,367
Data-data NaCl
Mr = 58,5
gr = 11,7 g
p = 1 L = 1000 g
∆Tf = 0 – (–0,744) = 0,744
α = 1 sehingga i = 2 (jumlah partikel NaCl)
Nah, sekarang kita tentukan tetapan penurunan titik beku molal urea.
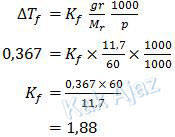
Sedangkan tetapan penurunan titik beku molal NaCl adalah:

Jadi, besar tetapan penurunan titik beku molal dari kedua percobaan, sesuai opsi jawaban yang ada adalah 1,86 ℃/m (D).
Perdalam materi ini di Pembahasan Kimia UN: Sifat Koligatif Larutan
Soal No. 25 tentang Sifat Koligatif Larutan Elektrolit dan Nonelektrolit
| No | Zat terlarut | Larutan | |
| Konsentrasi (m) | Titik beku (℃) | ||
| (1) | CO(NH2)2 | 1 | −2 |
| (2) | CO(NH2)2 | 2 | −4 |
| (3) | NaCl | 1 | −4 |
| (4) | NaCl | 2 | −8 |
Pada konsentrasi yang sama, larutan CO(NH2)2 dan NaCl memiliki titik beku yang berbeda. Hal ini disebabkan kedua larutan ….
A. mempunyai molekul yang tidak sama besarnya
B. mempunyai derajat ionisasi yang sama
C. menghasilkan jumlah partikel yang tidak sama banyak
D. sama-sama larutan elektrolit
E. sama-sama larutan nonelektrolit
Pembahasan
Pada tabel di atas, titik beku larutan NaCl selalu 2 kali lebih besar daripada titik beku larutan urea untuk konsentrasi yang sama. Hal ini disebabkan:
- Larutan urea adalah larutan nonelektrolit sehingga tidak mengalami ionisasi, hanya membentuk molekul CO(NH2)2 [hanya terdapat 1 partikel]
- Larutan NaCl adalah larutan elektrolit sehingga mengalami ionisasi membentuk Na+ dan Cl− [terbentuk 2 partikel]
Jadi, penyebab titik beku urea dan NaCl berbeda adalah karena keduanya menghasilkan jumlah partikel yang tidak sama banyak (C).
Perdalam materi ini di Pembahasan Kimia UN: Sifat Koligatif Larutan
Simak Pembahasan Soal Kimia UN 2018 selengkapnya.
Dapatkan pembahasan soal dalam file pdf di sini.
Terimakasih
Semoga Bermanfaat