pembahasan selanjutnya adalah

Pembahasan soal Kimia Ujian Nasional (UN) tahun 2018 nomor 1 sampai dengan nomor 5 tentang:
- sifat ikatan kimia,
- struktur atom,
- bentuk molekul,
- jenis ikatan kimia, dan
- hukum dasar kimia.
Soal No. 1 tentang Sifat Ikatan Kimia
A. lelehannya dapat menghantarkan listrik, ikatan ionik
B. larut dalam air, kovalen
C. tidak larut dalam air, ikatan ionik
D. larutannya menghantar listrik, kovalen
E. larutannya tidak menghantarkan listrik, ikatan ionik
Pembahasan
Untuk menentukan jenis ikatan, nomor atom unsur-unsur tersebut kita kurangi dengan nomor atom gas mulia terdekat.
X : 11 – 10 = +1 → X+
Y : 17 – 18 = −1 → Y−
Tampak jelas bahwa unsur X membentuk ion positif sedangkan unsur Y membentuk ion negatif sehingga ikatan yang terjadi adalah ikatan ionik.
X+ + Y− → XY
Ikatan tersebut seperti ikatan antara Na dan Cl:
Na+ + Cl− → NaCl
Adapun sifat ikatan ionik antara lain:
- larut dalam air
- menghantarkan listrik baik dalam bentuk lelehan maupun larutan
- titik didih dan titik leleh tinggi
Jadi, sifat dan jenis ikatan antara unsur X dan Y yang paling tepat adalah opsi (A).
Perdalam materi ini di Pembahasan Kimia UN: Sifat Ikatan Kimia
Soal No. 2 tentang Struktur Atom

Jika unsur A mempunyai jumlah neutron 12 dan B mempunyai jumlah neutron 18, pasangan data yang tepat adalah ….
| Option | Unsur | Golongan | Periode | Notasi |
| A. | A | IIA | 2 | 12A24 |
| B. | B | VIIIA | 3 | 18B36 |
| C. | A | IIA | 3 | 12A30 |
| D. | B | VIIA | 3 | 17B35 |
| E. | A | VIIIA | 2 | 18A36 |

Pembahasan
Setiap unsur mempunyai notasi:
ZXA
di mana:
Z : nomor atom (jumlah proton atau elektron)
A : nomor massa (jumlah proton + neutron)
Saat menentukan golongan dan periode, unsur harus dalam keadaan netral (tidak dalam bentuk ion) dan tidak dalam keadaan tereksitasi (elektron pindah lintasan).
Ion A2+ (melepas 2 elektron) mempunyai 10 elektron, maka:
- nomor atom : Z = 10 + 2 = 12
- nomor massa : A = 12 + 12 = 24
- notasi unsur : 12A24
- konfigurasi elektron : 1s2 2s2 2p63s2
- golongan : IIA
- periode : 3
Ion B− (menangkap 1 elektron) mempunyai 18 elektron, maka:
- nomor atom : Z = 18 − 1 = 17
- nomor massa : A = 17 + 18 = 35
- notasi unsur : 17B35
- konfigurasi elektron : 1s2 2s2 2p63s2 3p5
- golongan : VIIA
- periode : 3
Catatan:
Golongan A : ns atau ns np
Golongan B : ns (n − 1)d
Jadi, pasangan data yang tepat adalah opsi (D).
Perdalam materi ini di Pembahasan Kimia UN: Struktur Atom
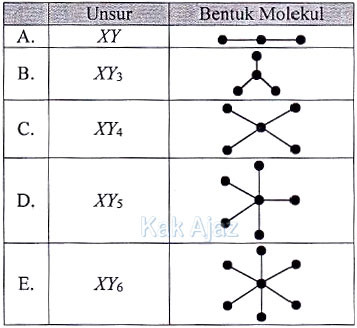
Soal No. 3 tentang Bentuk Molekul
X = 1s2 2s2 2p63s2 3p3
Y = 1s2 2s2 2p63s2 3p5
Jika kedua unsur tersebut bersenyawa, rumus kimia yang mungkin terjadi dan bentuk molekul senyawa yang benar adalah ….
Pembahasan
Elektron valensi (elektron terluar) dari unsur X dan Y adalah:
X = 1s2 2s2 2p63s2 3p3 [valensi 5]
Y = 1s2 2s2 2p63s2 3p5 [valensi 7]
Agar terpenuhi kaidah oktet (jumlah valensi 8) maka unsur X membutuhkan 3 elektron dari Y sedangkan unsur Y membutuhkan 1 elektron dari X. Sehingga terbentuk ikatan XY3 dengan struktur Lewis:

Perhatikan atom pusat X. Atom pusat X mempunyai 5 elektron terluar, 3 di antaranya digunakan untuk mengikat atom Y. Sisanya 2 elektron (sepasang elektron) dalam keadaan bebas. Adanya elektron bebas ini menyebabkan bentuk molekulnya segitiga piramida (trigonal piramida/limas segitiga) bukan segitiga datar. [opsi B salah bentuk molekulnya]
Berarti terbentuknya ikatan tidak berdasarkan kaidah oktet, tetapi berdasarkan kesimetrisan bentuk molekul.
Agar terbentuk molekul yang simetris maka kelima elektron valensi X berikatan dengan elektron Y membentuk molekul XY5.
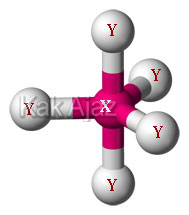
Karena semua elektron valensi dari unsur X berikatan maka tidak terdapat elektron bebas sehingga mempunyai bentuk molekul segitiga bipiramida atau trigonal bipiramida.
Jadi, rumus kimia dan bentuk molekul yang benar adalah opsi (D).
Catatan:
Ikatan antara unsur X dan Y di atas bisa membentuk senyawa XY3 atau XY5. Contohnya, PCl3 dan PCl5.
Perdalam materi ini di Pembahasan Kimia UN: Bentuk Molekul
Soal No. 4 tentang Jenis Ikatan Kimia
Pembahasan
Soal no. 4 ini mirip dengan soal no. 3. Cuma beda pertanyaan saja.
Ok, mari kita tentukan konfigurasinya dulu!
7A = 2, 5 [valensi 5]
17B = 2, 8, 7 [valensi 7]
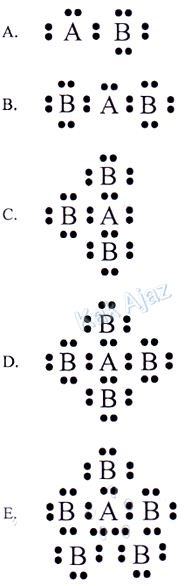
Unsur A mempunyai valensi 5 sehingga membutuhkan 3 elektron agar terpenuhi kaidah oktet. Sedangkan unsur B bervalensi 7 sehingga hanya membutuhkan 1 elektron.
Dengan demikian, senyawa yang terbentuk adalah AB3.

Jadi, struktur Lewis yang benar adalah opsi (C).
Perdalam materi ini di Pembahasan Kimia UN: Jenis Ikatan Kimia
Soal No. 5 tentang Hukum Dasar Kimia
A. Hukum Perbandingan Tetap (Proust)
B. Hukum Perbandingan Volume (Gay Lussac)
C. Hukum Kekekalan Massa (Lavoisier)
D. Hukum Perbandingan Berganda (Dalton)
E. Hukum Perbandingan Molekul (Avogadro)
Pembahasan
Empat Hukum Dasar Kimia yang terkenal adalah:
- Hukum Kekekalan Massa (Hukum Lavoisier)
Massa zat-zat sebelum dan sesudah reaksi adalah sama
- Hukum Perbandingan Tetap (Hukum Proust)
Perbandingan massa unsur-unsur dalam suatu senyawa adalah tetap
- Hukum Kelipatan Perbandingan {Hukum Dalton)
Jika dua jenis unsur bergabung membentuk lebih dari satu macam senyawa maka perbandingan massa unsur dalam senyawa-senyawa tersebut merupakan bilangan bulat sederhana
- Hukum Perbandingan Volume (Hukum Gay-Lussac}
Pada suhu dan tekanan yang sama, perbandingan volume gas-gas yang bereaksi dan hasil reaksi merupakan bilangan bulat sederhana
Pada soal di atas, massa zat sebelum reaksi (7 gram besi dan 4 gram sulfur) adalah 11 gram. Sedangkan massa zat sesudah reaksi adalah 11 gram besi sulfida.
Jadi, hukum dasar kimia yang tepat adalah Hukum Kekekalan Massa atau Hukum Lavoisier (C).
Perdalam materi ini di Pembahasan Kimia UN: Hukum Dasar Kimia
Simak Pembahasan Soal Kimia UN 2018 selengkapnya.
Dapatkan pembahasan soal dalam file pdf di sini.
Terimakasih
Semoga Bermanfaat