pembahasan selanjutnya adalah

Pembahasan soal Kimia Ujian Nasional (UN) tahun 2017 nomor 31 sampai dengan nomor 35 tentang:
- sifat koligatif larutan,
- sifat koligatif larutan elektrolit dan nonelektrolit,
- sel elektrokimia,
- sel elektrolisis, serta
- kelimpahan unsur di alam.
Soal No. 31 tentang Sifat Koligatif Larutan
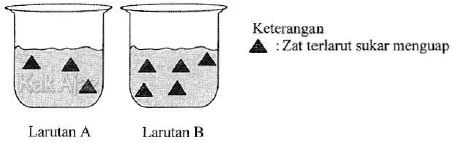
Pernyataan yang tepat untuk kedua larutan tersebut adalah ….
A. tekanan osmotik larutan A lebih tinggi daripada larutan B
B. titik didih larutan A lebih tinggi daripada larutan B
C. titik beku larutan A lebih tinggi daripada larutan B
D. tekanan uap larutan A lebih rendah daripada larutan B
E. larutan A isotonik dengan larutan B
Pembahasan
Ilustrasi komposisi larutan di atas menunjukkan bahwa larutan A mempunyai jumlah zat terlarut lebih sedikit dibandingkan dengan larutan B. Berarti konsentrasi larutan A lebih rendah daripada konsentrasi larutan B.
konsentrasi A < konsentrasi B
Dalam kimia, konsentrasi bisa diwakili oleh jumlah mol (n), molalitas (m), molaritas (M), normalitas (N), atau fraksi mol zat terlarut (xz).
Mari kita analisis satu per satu setiap opsi jawaban di atas!
- Tekanan osmotik dirumuskan sebagai:
π = MRTi
π ~ M
Karena MA < MB maka πA < πA [opsi A salah]
- Kenaikan titik didih dirumuskan sebagai:
∆tb = Kbm i
∆tb ~ m
Karena mA < mB maka kenaikan titik didih larutan A lebih rendah daripada larutan B sehingga tbA < tbB [opsi B salah]
- Penurunan titik beku dirumuskan sebagai:
∆tf = Kfm i
∆tf ~ m
Karena mA < mB maka penurunan titik didih larutan A lebih rendah daripada larutan B sehingga tfA > tfB [opsi C benar]
Catatan: penurunan titik beku tinggi berarti titik bekunya rendah.
- Penurunan tekanan uap dirumuskan sebagai:
∆p = p ∙ xz
∆p ~ xz
Karena xzA < xzB maka penurunan tekanan uap larutan A lebih rendah daripada larutan B sehingga pA > pB [opsi D salah]
Catatan: sama halnya dengan penurunan titik beku, penurunan tekanan uap besar berarti tekanan uapnya kecil.
- Larutan isotonik adalah dua larutan yang mempunyai tekanan osmotik yang sama. Berdasarkan ilustrasi komposisi larutan di atas, tampak bahwa kedua larutan tidak isotonik. [opsi E salah]
Jadi, pernyataan yang tepat untuk kedua larutan tersebut adalah opsi (C).
Perdalam materi ini di Pembahasan Kimia UN: Sifat Koligatif Larutan.
Soal No. 32 tentang Sifat Koligatif Larutan Elektrolit dan Nonelektrolit
| Larutan | Konsentrasi | Titik Didih |
| nonelektrolit | 1 m | 101,80 ℃ |
| elektrolit terner | 1 m | 104,68 ℃ |
Derajat ionisasi larutan elektrolit terner tersebut adalah ….
A. 0,40
B. 0,50
C. 0,80
D. 0,90
E. 1,00

Pembahasan
Kita tinjau dulu kenaikan titik didih untuk larutan nonelektrolit (i = 1).
∆tb = Kbm i
101,80 − 100 = Kb ∙ 1 ∙ 1
Kb = 1,80
Selanjutnya kita gunakan harga Kb di atas pada larutan elektrolit terner. Larutan elektrolit terner adalah larutan yang dapat terion menjadi tiga partikel (n = 3).
∆tb = Kbm i
104,68 − 100 = 1,80 ∙ 1 ∙ i
4,68 = 1,80i
i = 2,6
i adalah faktor Van’t Hoff yang dirumuskan sebagai:
i = 1 + (n − 1)α
dengan n adalah jumlah partikel dan α adalah derajat ionisasi. Sehingga diperoleh:
2,6 = 1 + (3 − 1)α
2,6 = 1 + 2α
1,6 = 2α
α = 0,8
Jadi, derajat ionisasi larutan elektrolit terner tersebut adalah 0,8 (C).
Perdalam materi ini di Pembahasan Kimia UN: Sifat Koligatif Larutan.
Soal No. 33 tentang Sel Elektrokimia
Cr3+(aq) + 3e → Cr(s) E = −0,71 volt
Ag+(aq) + e → Ag(s) E = +0,80 volt
Al3+(aq) + 3e → Al(s) E = −1,66 volt
Zn2+(aq) + 2e → Zn(s) E = −0,74 volt
Diagram sel yang dapat berlangsung spontan adalah ….
A. Ag/Ag+//Cr3+/Cr
B. Ag/Ag+//Zn2+/Zn
C. Cr/Cr3+//Al3+/Al
D. Zn/Zn2+//Al3+/Al
E. Zn/Zn2+//Ag+/Ag
Pembahasan
Diagram sel dapat berlangsung bila memenuhi ketentuan berikut ini:

Berdasarkan ketentuan di atas, kita urutkan harga E di atas dari kecil ke besar.
Al3+(aq) + 3e → Al(s) E = −1,66 volt
Zn2+(aq) + 2e → Zn(s) E = −0,74 volt
Cr3+(aq) + 3e → Cr(s) E = −0,71 volt
Ag+(aq) + e → Ag(s) E = +0,80 volt
Agar lebih mudah, kita urutkan secara mendatar.
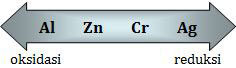
Dengan demikian, yang berlangsung spontan adalah:
Zn/Zn2+//Ag+/Ag
Jadi, diagram sel yang dapat berlangsung spontan adalah opsi (E).
Perdalam materi ini di Pembahasan Kimia UN: Reaksi Redoks dan Elektrokimia.
Soal No. 34 tentang Sel Elektrolisis
- Elektrolisis larutan NaCl dengan elektroda C
- Elektrolisis larutan K2SO4 dengan elektroda C
- Elektrolisis leburan CaCl2 dengan elektroda Pt
- Elektrolisis leburan CuCl2 dengan elektroda C
Reaksi yang sama terjadi di katoda terdapat pada reaksi nomor ….
A. (1) dan (2)
B. (1) dan (3)
C. (1) dan (4)
D. (2) dan (3)
E. (3) dan (4)
Pembahasan
Reaksi yang terjadi di katoda bergantung pada fase zat dan jenis kation. Reaksi (1) dan (2) berfase larutan (mengandung air) dan kation merupakan logam golongan IA sehingga terjadi reduksi air.
Reaksi (1) dan (2): 2H2O + 2e → 2OH− + H2
Sedangkan reaksi (3) dan (4) berfase leburan sehingga di katoda terjadi reduksi kation (apapun jenis logamnya).
Reaksi (3): Ca2+ + 2e → Ca
Reaksi (4): Cu2+ + 2e → Cu
Jadi, reaksi yang sama terjadi di katoda terdapat pada reaksi nomor 1 dan 2 (A).
Perdalam materi ini di Pembahasan Kimia UN: Sel Elektrolisis dan Hukum Faraday.
Soal No. 35 tentang Kelimpahan Unsur di Alam
| No. | Mineral | Unsur |
| (1) | pirit | besi |
| (2) | bauksit | tembaga |
| (3) | kriolit | aluminium |
| (4) | kalkopirit | kalsium |
| (5) | hematit | tembaga |
Pasangan data yang tepat antara mineral dan unsurnya adalah nomor ….
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (4)
D. (3) dan (4)
E. (4) dan (5)
Pembahasan
Mari kita periksa satu per satu kandungan mineral di atas!
- Pirit (FeS2) mengandung unsur besi (Fe) dan belerang (S). [no. 1 benar]
- Bauksit (Al2O3.xH2O) mengandung unsur aluminium (Al). [no. 2 salah]
- Kriolit (Na3AlF6) mengandung unsur natrium (Na), aluminium (Al), dan fluorin (F). [no. 3 benar]
- Kalkopirit (CuFeS2) mengandung unsur tembaga (Cu), besi (Fe), dan belerang (S).
- Hematit (Fe2O3) mengandung unsur besi (Fe). [no. 5 salah]
Jadi, pasangan data yang tepat antara mineral dan unsurnya adalah nomor 1 dan 3 (B).
Perdalam materi ini di Pembahasan Kimia UN: Kelimpahan Unsur di Alam.
Simak Pembahasan Soal Kimia UN 2017 selengkapnya.
Dapatkan pembahasan soal dalam file pdf di sini.
Terimakasih
Semoga Bermanfaat
