pembahasan selanjutnya adalah

Pembahasan soal Kimia Ujian Nasional (UN) tahun 2017 nomor 21 sampai dengan nomor 25 tentang:
- konstanta kesetimbangan,
- teori asam dan basa,
- pH asam dan basa,
- titrasi asam dan asam, serta
- hidrolisis garam.
Soal No. 21 tentang Konstanta Kesetimbangan
A2(g) + B2(g) ⇌ 2AB(g)
Mula-mula direaksikan 0,5 mol A2 dengan 0,5 mol B2 dalam ruang 1 liter pada suhu 27 ℃. Ternyata setelah kesetimbangan tercapai terdapat 0,3 mol gas AB. Jika tekanan total gas pada reaksi itu adalah 10 atmosfer, nilai Kp untuk reaksi tersebut adalah ….
A. 0,30
B. 0,35
C. 0,73
D. 2,3
E. 3,5
Pembahasan
Reaksi yang terjadi adalah sebagai berikut:
| A2 | + | B2 | ⇌ | 2AB | ||
| mula-mula | : | 0,50 | 0,50 | – | ||
| reaksi | : | 0,15 | 0,15 | 0,3 | ||
| setimbang | : | 0,35 | 0,35 | 0,3 |
Tekanan parsial tiap zat dapat ditentukan berdasarkan perbandingan konsentrasi masing-masing.

Dengan demikian, nilai konstanta kesetimbangan tekanan, Kp, adalah:
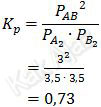
Jadi, nilai Kp untuk reaksi tersebut adalah 0,73 (C).
Perdalam materi ini di Pembahasan Kimia UN: Kesetimbangan Kimia.
Soal No. 22 tentang Teori Asam dan Basa
- NH3(g) + BF3(g) → NH3BF3(g)
- H3PO4(aq) → H+(aq) + H2PO4−(aq)
- PO43−(aq) + H2O(l) ⇌ HPO42−(aq) + H+(aq)
Urutan yang sesuai dengan konsep asam-basa Arrhenius, Bronsted-Lowry, dan Lewis adalah ….
A. (1), (2), (3)
B. (2), (1), (3)
C. (2), (3), (1)
D. (3), (1), (2)
E. (3), (2), (1)

Pembahasan
Tiga teori asam-basa yang perlu kita ketahui adalah sebagai berikut:
Teori Arrhenius
Asam : zat yang melepas H+
Basa : zat yang melepas OH−
Contoh:
H3PO4(aq) → H+(aq) + H2PO4−(aq)
H3PO4 melepas ion H+ dan membentuk H2PO4−. Dengan demikian, H3PO4 bertindak sebagai asam sedangkan H2PO4− sebagai basa.
Teori Bronsted-Lowry
Asam : donor proton (kelebihan 1 H+ terhadap konjugatnya)
Basa : donor elektron (kekurangan 1 H+ terhadap konjugatnya)
Contoh:
PO43−(aq) + H2O(l) ⇌ HPO42−(aq) + H+(aq)
PO43− berkonjugat dengan HPO42−. Yang bertindak sebagai asam adalah HPO42− karena mempunyai kelebihan 1 H+.
Sedangkan H2O berkonjugat dengan H+. Yang bertindak sebagai asam H2O karena mempunyai kelebihan 1 H+.
Teori Lewis
Asam : akseptor elektron (kekurangan elektron)
Basa : donor elektron (kelebihan elektron)
Contoh:
NH3(g) + BF3(g) → NH3BF3(g)
Atom N mempunyai 5 elektron valensi, 3 di antaranya digunakan untuk berikatan dengan atom H sehingga tersisa 2 elektron. Kelebihan elektron ini digunakan untuk mengikat BF3.
Dengan demikian, NH3 bertindak sebagai basa karena menyumbangkan elektron, sedangkan BF3 bertindak sebagai asam.
Jadi, urutan yang sesuai dengan konsep asam-basa Arrhenius, Bronsted-Lowry, dan Lewis adalah nomor 2, 3, dan 1 (C).
Perdalam materi ini di Pembahasan Kimia UN: Asam dan Basa.
Soal No. 23 tentang pH asam dan Basa
| No. | Nama Indikator | Trayek pH | Perubahan Warna Hasil | Pengamatan | |
| Larutan X | Larutan Y | ||||
| (1) | metil merah | 4,2 – 6,3 | merah – kuning | kuning | merah |
| (2) | metil jingga | 3,2 – 4,4 | merah – kuning | kuning | jingga |
| (3) | metil ungu | 4,8 – 5,4 | ungu – hijau | hijau | ungu |
| (4) | lakmus | 4,7 – 8,3 | merah – biru | biru | merah |
Perkiraan pH untuk larutan X dan larutan Y secara berurutan adalah ….
A. 3,2 – 4,4 dan 5,8 – 8,3
B. 4,4 – 4,8 dan 4,7 – 5,4
C. 4,8 – 5,4 dan 4,4 – 4,8
D. 4,7 – 8,3 dan 3,2 – 4,0
E. 8,3 – 14,0 dan 3,2 – 4,2
Pembahasan
Untuk menyelesaikan soal di atas, mari kita paham konsep berikut!
Misalkan suatu skala mempunyai batas terendah a dan batas tertinggi b:
- Jika pengujian menunjukkan a maka nilainya ≤ a.
- Jika pengujian menunjukkan b maka nilainya ≥ b.
Berdasarkan konsep di atas, mari kita tentukan kisaran pH larutan X dan Y!
Larutan X
metil merah : x ≥ 6,3
metil jingga : x ≥ 4,4
metil ungu : x ≥ 5,4
lakmus : x ≥ 8,3

kisaran pH : 8,3 – 14
Larutan Y
metil merah : y ≤ 4,2
metil jingga : 3,2 ≤ y ≤ 4,4
metil ungu : y ≤ 4,8
lakmus : y ≤ 4,7

kisaran pH : 3,2 – 4,2
Jadi, perkiraan pH untuk larutan X dan larutan Y secara berurutan adalah 8,3 – 14,0 dan 3,2 – 4,2 (E).
Perdalam materi ini di Pembahasan Kimia UN: Asam dan Basa.
Soal No. 24 tentang Titrasi Asam dan Basa
| Percobaan | Volume Ba(OH)2 | Volume CH3COOH 0,15 M |
| 1 | 30 mL | 39,8 mL |
| 2 | 30 mL | 40,0 mL |
| 3 | 30 mL | 40,2 mL |
Berdasarkan data tersebut, massa Ba(OH)2 yang bereaksi adalah … (Ar Ba = 56 gram.mol−; O = 16 gram.mol−; H = 1 gram.mol−).
A. 0,54 gram
B. 0,30 gram
C. 0,27 gram
D. 0,15 gram
E. 0,10 gram
Pembahasan
Misalkan indeks (1) mewakili Ba(OH)2 dan indeks (2) mewakili CH3COOH.
V1 = 30 mL
n1 = 2 [jumlah ion OH−]
Mr1 = 56 + 2(16 + 1) = 90
M2 = 0,15 M
V2 = (39,8 + 40 + 40,2)/3 = 40 mL
n2 = 1 [jumlah ion H+]
Pada titrasi asam dan basa berlaku hubungan:
M1V1n1 = M2V2n2
M1 ∙ 30 ∙ 2 = 0,15 ∙ 40 ∙ 1
60M1 = 6
M1 = 0,1
Nah, sekarang kita tentukan massa Ba(OH)2 dengan memanfaatkan rumus molaritas.
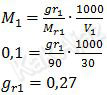
Jadi, massa Ba(OH)2 yang bereaksi adalah 0,27 gram (C).
Perdalam materi ini di Pembahasan Kimia UN: Asam dan Basa.
Soal No. 25 tentang Hidrolisis Garam
| No. | Larutan | Uji Lakmus | Jenis Hidrolisis | Persamaan Reaksi Hidrolisis | |
| Merah | Biru | ||||
| (1) | (NH4)2SO4 | merah | merah | … | NH4+ + H2O ⇌ NH4OH + H+ |
| (2) | NaF | … | biru | parsial | F− + H2O ⇌ HF + OH− |
| (3) | HCOOK | biru | biru | parsial | … |
Data yang tepat untuk mengisi bagian titik-titik pada nomor (1), (2), dan (3) berturut-turut adalah ….
| A. | parsial | merah | HCOO− + H2O ⇌ OH− + HCOOH |
| B. | parsial | biru | HCOO− + H2O ⇌ OH− + HCOOH |
| C. | total | biru | NH4OH + HCOOH ⇌ NH4+ + HCOO− + H2O |
| D. | parsial | merah | NH4+ + H2O ⇌ NH4OH + H+ |
| E. | total | merah | HCOO− + H2O ⇌ OH− + HCOOH |
Pembahasan
Mari kita periksa satu per satu sifat dari ketiga larutan garam di atas! Bagian yang bercetak warna biru merupakan jawaban.
(NH4)2SO4
- Berasal dari basa lemah NH4OH dan asam kuat H2SO4 sehingga bersifat asam. Pada uji lakmus akan menunjukkan warna merah.
- Karena hanya basanya saja yang lemah maka termasuk hidrolisis parsial (sebagian).
- Reaksi hidrolisis terjadi pada ion NH4+ karena ion ini berasal dari basa lemah: NH4+ + H2O ⇌ NH4OH + H+
NaF
- Berasal dari basa kuat NaOH dan asam lemah HF sehingga bersifat basa. Pada uji lakmus akan menunjukkan warna biru.
- Karena hanya asamnya saja yang lemah maka termasuk hidrolisis parsial.
- Reaksi hidrolisis terjadi pada ion F− karena ion ini berasal dari asam lemah. F− + H2O ⇌ HF + OH−
HCOOK
- Berasal dari basa kuat KOH dan asam lemah HCOOH sehingga bersifat basa. Pada uji lakmus akan menunjukkan warna biru.
- Karena hanya asamnya saja yang lemah maka termasuk hidrolisis parsial.
- Reaksi hidrolisis terjadi pada ion HCOO− karena ion ini berasal dari asam lemah: HCOO− + H2O ⇌ OH− + HCOOH.
Jadi, jawaban yang tepat adalah opsi (B).
Perdalam materi ini di Pembahasan Kimia UN: Hidrolisis Garam.
Simak Pembahasan Soal Kimia UN 2017 selengkapnya.
Dapatkan pembahasan soal dalam file pdf di sini.
Terimakasih
Semoga Bermanfaat
