pembahasan selanjutnya adalah
 |
| Percobaan untuk mengetahui adanya muatan elektron |
Pembahasan soal Kimia Ujian Nasional (UN) tahun 2017 nomor 1 sampai dengan nomor 5 tentang:
- teori atom,
- massa atom relatif,
- struktur atom,
- sistem periodik unsur, dan
- jenis ikatan kimia.
Soal No. 1 tentang Teori Atom

Berdasarkan diagram tersebut, pernyataan yang tepat tentang sinar katoda adalah ….
A. sinar katoda yang dihasilkan tergantung dari zatnya
B. sinar katoda dibelokkan ke pelat logam positif
C. sinar katoda bergerak dari S ke R
D. muatan elektron 1,6 × 10−9 Coulomb
E. sinar katoda tidak dibelokkan medan magnet
Pembahasan
Dari percobaan di atas, Thomson menemukan bahwa ada partikel lain yang lebih kecil dari atom dan bermuatan negatif. Adanya partikel bermuatan negatif ini (sekarang disebut elektron) dibuktikan dengan adanya:
- Sinar katoda dibelokkan (tertarik) ke pelat logam positif. Hal ini berarti sinar katoda tersebut merupakan partikel yang bermuatan negatif. [opsi B benar]
- Karena merupakan partikel bermuatan negatif maka sinar katoda bergerak menuju listrik positif, yaitu dari R ke S. [opsi C salah]
- Karena dapat dibelokkan dalam medan listrik, maka sinar katoda juga dapat dibelokkan dalam medan magnet. [opsi E salah]
- Thomson hanya menemukan perbandingan antara muatan dengan massa elektron (e/m). Sedangkan muatan elektron ditemukan oleh Robert Millikan. [opsi D salah]
Jadi, pernyataan yang tepat tentang sinar katoda adalah opsi (B).
Soal No. 2 tentang Massa Atom Relatif


Pembahasan
Massa atom relatif suatu unsur merupakan perbandingan antara massa rata-rata 1 unsur dengan 1/12 massa 1 atom C-12.

Jadi, massa atom relatif unsur Q adalah opsi (C).
Soal No. 3 tentang Struktur Atom
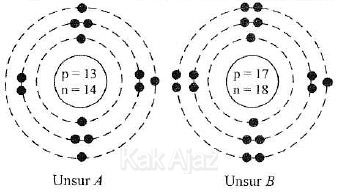
Berdasarkan diagram tersebut, notasi unsur A dan B yang benar adalah ….
A. 11A23 dan 15B30
B. 13A27 dan 17B35
C. 13A26 dan 17B34
D. 27A13 dan 35B17
E. 27A13 dan 15B30
Pembahasan
Notasi unsur dirumuskan sebagai:
ZXA
dengan:
Z : nomor atom (= jumlah proton)
A : nomor massa (= jumlah proton + neutron)
Nah, sekarang kita perhatikan susunan partikel unsur A dan B.
p = 13
n = 14
Z = p = 13
A = p + n = 13 + 14 =2 7
Notasi unsur : 13A27
p =1 7
n = 18
Z = p = 17
A = p + n = 17 + 18 =3 5
Notasi unsur : 17B35
Jadi, notasi unsur A dan B yang benar adalah opsi (B).
Perdalam materi ini di Pembahasan Kimia UN: Struktur Atom.
Soal No. 4 tentang Sistem Periodik Unsur
| Unsur | Afinitas Elektron |
| X | 240 kJ.mol−1 |
| Y | −349 kJ.mol−1 |
Pernyataan yang tepat untuk kedua unsur tersebut dalam mencapai kestabilan adalah ….
A. ion X− lebih stabil daripada atom X
B. ion Y− lebih stabil daripada atom Y
C. Y lebih mudah melepas elektron daripada X
D. X lebih bersifat nonlogam daripada Y
E. X lebih mudah menarik elektron daripada Y
Pembahasan
Afinitas elektron adalah besarnya energi yang dilepaskan oleh suatu atom ketika menangkap elektron (membentuk ion negatif). Unsur yang memiliki afinitas elektron bertanda negatif, mempunyai kecenderungan lebih besar dalam membentuk ion negatif.
Berdasarkan keterangan di atas, unsur yang mempunyai afinitas elektron negatif, yaitu Y, bersifat:
- lebih mudah menangkap elektron
- lebih stabil membentuk Y−
- lebih bersifat nonlogam
Jadi, pernyataan yang tepat adalah opsi (B).
Perdalam materi ini di Pembahasan Kimia UN: Sistem Periodik Unsur.
Soal No. 5 tentang Jenis Ikatan Kimia
6K, 8L, 15M, 17Q, 9R, memenuhi aturan oktet, kecuali ….
A. KL2 dan KQ4
B. KQ4 dan Q2L
C. MQ5 dan KL
D. MQ3 dan KR4
E. KQ4 dan KL2
Pembahasan
Cara mudah untuk menentukan suatu senyawa memenuhi kaidah oktet atau bukan adalah dengan menghafal nomor atom gas mulia berikut ini:
2, 10, 18 36, 54, 86
Misal senyawa KL2, nomor atom unsur K kita kurangi dengan nomor gas mulia di bawahnya sehingga hasilnya positif. Sedangkan nomor atom unsur L kita kurangi dengan nomor atom gas mulia di atasnya sehingga hasilnya negatif. Hasil negatif ini kemudian kita beri harga mutlak sehingga menghasilkan nilai positif.
6K : 6 – 2 = 4
8L : |8 – 10| = 2
Selanjutnya, nilai tersebut kita jumlahkan sesuai jumlah unsur. Jika hasilnya 8 maka memenuhi kaidah oktet.
KL2 : 4 + 2×2 = 8 [oktet]
Mari kita periksa untuk senyawa yang lain!
6K : 6 – 2 = 4
17Q : |17 – 18| = 1
KQ4 : 4 + 4×1 = 8 [oktet]
8L : 8 – 2 = 6
17Q : |17 – 18| = 1
Q2L : 2×1 + 6 = 8 [oktet]
15M : 15 – 10 = 5
17Q : |17 – 18| = 1
MQ5 : 5 + 5×1 = 10 [bukan oktet]
6K : 6 – 2 = 4
8L : |8 – 10| = 2
KL : 4 + 2 = 6 [bukan oktet]
15M : 15 – 10 = 5
17Q : |17 – 18| = 1
MQ3 : 5 + 3×1 = 8 [oktet]
6K : 6 – 2 = 4
9R : |9 – 10| = 1
KR4 : 4 + 4×1 = 8 [oktet]
6K : 6 – 2 = 4
17Q : |17 – 18| = 1
KQ4 : 4 + 4×1 = 8 [oktet]
Jadi, pasangan senyawa yang tidak memenuhi kaidah oktet adalah MQ5 dan KL (C).
Perdalam materi ini di Pembahasan Kimia UN: Jenis Ikatan Kimia.
Simak Pembahasan Soal Kimia UN 2017 selengkapnya.
Dapatkan pembahasan soal dalam file pdf di sini.
Terimakasih
Semoga Bermanfaat
