pembahasan selanjutnya adalah
- alkohol dan eter,
- uji senyawa karbon,
- tata nama benzena,
- turunan benzena. serta
- energetika.
Soal No. 21 tentang Senyawa Karbon (Alkohol dan Eter)
A. 1-propanol
B. 2-propanol
C. metoksi metana
D. metoksi etana
E. propanon
Pembahasan
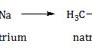
Senyawa karbon dengan rumus molekul C3H8O adalah senyawa dari golongan alkohol atau eter (CnH2n+2O). Sedangkan yang dapat bereaksi dengan logam natrium adalah dari golongan alkohol. Alkohol primer jika bereaksi dengan logam natrium akan membentuk natrium alkoholat dan gas hidrogen.

Jadi, senyawa dengan rumus molekul tersebut adalah 1-propanol (A).
Soal No. 22 tentang Uji Senyawa Karbon
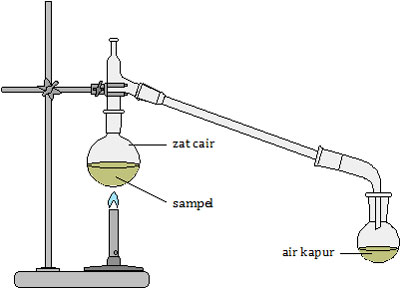
Zat cair yang dihasilkan pada tabung reaksi diuji dengan kertas kobalt (II) klorida yang berwarna biru berubah menjadi merah jambu. Hal ini membuktikan bahwa sampel (senyawa karbon) tersebut mengandung unsur ….
A. kalsium dan oksigen
B. kalsium dan hidrogen
C. hidrogen dan nitrogen
D. nitrogen dan oksigen
E. hidrogen dan oksigen

Penyelesaian
Uji senyawa karbon bertujuan untuk membuktikan adanya unsur C, H, dan O.
Sebenarnya soal tersebut tidak padu antara gambar dan pernyataan. Gambar tersebut adalah percobaan untuk membuktikan adanya unsur C dan O. Senyawa karbon yang dipanaskan akan menghasilkan uap. Uap tersebut akan mengalir menuju air kapur. Jika air kapur yang semula jernih menjadi keruh maka terbukti bahwa senyawa karbon tersebut melepas uap CO2 yang berarti mengandung unsur C dan O.
Sedangkan pengujian dengan kertas kobalt (II) klorida atau CoCl2 tidak perlu menggunakan air kapur. Cukup memanaskan senyawa karbon yang akan diuji. Ketika sudah mendidih, kertas kobalt tersebut dimasukkan. Jika terjadi perubahan warna dari biru menjadi merah jambu berarti pemanasan tersebut menghasilkan uap air atau H2O. Hal ini membuktikan bahwa senyawa karbon tersebut mengandung unsur H dan O.
Jadi, berdasarkan uji kertas kobalt (II) klorida, senyawa karbon tersebut mengandung unsur hidrogen dan oksigen (E).
Perdalam materi ini di Pembahasan Kimia UN: Senyawa Karbon.
Soal No. 23 tentang Tata Nama Benzena
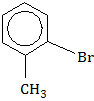
Nama senyawa tersebut adalah ….
A. bromo metil benzena
B. metil bromobenzena
C. 2-metil bromotoluena
D. para-bromotoluena
E. orto-bromotoluena
Jawab
Cabang CH3 merupakan gugus fungsional sehingga penomoran atom C benzena dimulai dari C yang mengikat CH3. Benzena dengan gugus fungsional CH3 mempunyai nama trivial toluena.
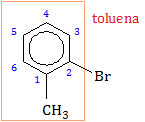
Senyawa turunan benzena tersebut dapat diberi nama dengan dua cara, yaitu:
Benzena sebagai induk (metil dan bromo sebagai cabang)
- 2-bromo-1-metilbenzena
- orto-bromometilbenzena
- o-bromometilbenzena
Toluena sebagai induk (bromo sebagai cabang)
- 2-bromotoluena
- orto-bromotoluena
- o-bromotoluena
Jadi, sesuai opsi yang ada, nama senyawa turunan benzena tersebut adalah orto-bromotoluena (E).
Perdalam materi ini di:
Pembahasan Kimia UN: Benzena dan Turunannya.
Pembahasan Soal UN: Tata Nama Senyawa Organik dan Anorganik.
Soal No. 24 tentang Turunan Benzena
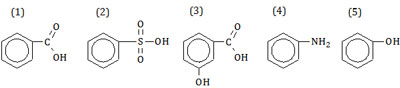
Senyawa yang digunakan sebagai obat gosok dan desinfektan berturut-turut adalah ….
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (4)
D. (3) dan (4)
E. (3) dan (5)
Pembahasan
Nama dan kegunaan senyawa turunan benzena sesuai urutan pada soal.
- Asam benzoat: bahan baku pengawet makanan.
- Asam benzena sulfonat: bahan baku pembuatan obat dan pemanis buatan.
- Asam m-hidroksi benzoat: obat anti jamur atau obat gosok.
- Anilina: bahan baku pembuatan zat warna, bahan bakar, roket, dan bahan peledak.
- Fenol: antiseptik/desinfektan, pengawet kayu, bahan baku zat warna, dan obat-obatan.
Perdalam materi ini di Pembahasan Kimia UN: Benzena dan Turunannya.
Soal No. 25 tentang Energetika

Perubahan entalpi (ΔH1) reaksi tersebut sebesar ….
A. −218,00 kJ
B. −235,50 kJ
C. −276,60 kJ
D. −335,20 kJ
E. −344,60 kJ
Penyelesaian
Coba perhatikan grafik pada soal. Grafik tersebut sangat membantu dalam menentukan persamaannya. Secara sederhana, grafik tersebut dapat diterjemahkan bahwa panah yang panjang sama dengan jumlah dari dua panah yang pendek. Sehingga diperoleh persamaan:
ΔH1 = ΔH2 + ΔH3
= −276,6 + (−58,6)
= −335,2
Jadi, perubahan entalpi (ΔH1) reaksi tersebut adalah −335,20 kJ (D).
Simak Pembahasan Soal Kimia UN 2015 selengkapnya.
Dapatkan pembahasan soal dalam file pdf di sini.
Terimakasih
Semoga Bermanfaat