pembahasan selanjutnya adalah
Pembahasan soal Kimia UN 2015 nomor 11 sampai dengan nomor 15 tentang:
- larutan penyangga,
- pH asam dan basa,
- kelarutan dan hasil kali kelarutan,
- hidrolisis garam, serta
- larutan elektrolit dan nonelektrolit.
Soal No. 11 tentang Larutan Penyangga
- H2CO3
- H2SO4
- H2PO4−
- HCO3−
- HPO42−
Pasangan ion/senyawa yang berguna sebagai penyangga pada ekstrasel adalah ….
A. (1) dan (2)
B. (1) dan (4)
C. (2) dan (3)
D. (2) dan (5)
E. (3) dan (4)
Pembahasan
Larutan penyangga mengandung campuran asam lemah dengan basa konjugasinya atau basa lemah dengan asam konjugasinya. Jika suatu asam lemah mengandung CO3 maka basa konjugasinya juga harus mengandung CO3. Bedanya, yang mempunyai jumlah atom H lebih besar adalah asam.
Berikut ini adalah asam lemah dan basa konjugasinya yang terdapat pada soal.
| Asam Lemah | Basa Konjugasinya |
| H2CO3 | HCO3− |
| H2SO4 | HSO4− |
| H2PO4− | HPO42− |
Berdasarkan tabel di atas, yang sesuai dengan opsi jawaban hanya H2CO3 dan HCO3−. Secara kebetulan pasangan asam basa konjugasi ini merupakan penyangga alami yang terdapat dalam cairan ekstrasel makhluk hidup. Sedangkan H2PO4− dan terdapat HPO42− dalam cairan intrasel.
Jadi, pasangan ion/senyawa yang berguna sebagai penyangga ekstrasel adalah nomor 1 dan 4 (B).
Perdalam materi ini di Pembahasan Kimia UN: Larutan Penyangga.
Soal No. 12 tentang pH Asam dan Basa
A. 2 + log 1
B. 3 − log 5
C. 3 + log 5
D. 11 + log 5
E. 12 + log 5

Pembahasan
Melarutkan H2SO4 dalam aquades atau air hanya merupakan pengenceran atau pembentukan larutan. Yang berubah hanya konsentrasi atau kepekatan dari asam sulfat tersebut. Konsentrasi larutan H2SO4 dalam satuan molar adalah:
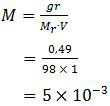
Asam sulfat merupakan asam kuat sehingga rumus keasamannya adalah:
[H+] = a . M
= 2 . 5 × 10−3
= 1 × 10−2
dengan a adalah banyak ion H+ dalam H2SO4, yaitu 2. Dengan demikian diperoleh
pH = −log [H+]
= −log 1 × 10−2
= 2 + log 1
Jadi, pH larutan yang terbentuk adalah 2 + log 1 (A).
Soal No. 13 tentang Kelarutan dan Hasil Kali Kelarutan
A. 6 gram
B. 9 gram
C. 60 gram
D. 100 gram
E. 120 gram
Pembahasan
Reaksi antara CaCl2 dan Na2CO3 adalah sebagai berikut:
CaCl2 + Na2CO3 → CaCO3 + 2NaCl
Berdasarkan persamaan reaksi tersebut, sebenarnya kita masih belum tahu zat mana yang mengendap, CaCO3 atau NaCl? Ini harus diuji dahulu dengan nilai Ksp masing-masing. Karena nilai Ksp yang diketahui pada soal hanya CaCO3, dapat dipastikan yang mengendap adalah CaCO3.
mol CaCl2 = M × V
= 0,6 M × 100 ml
= 60 mmol
mol CaCO3 = mol CaCl2
= 60 mmol
(hukum kesetaraan mol dan koefisien)
Mr CaCO3 = 40 + 12 + 3×16
= 100
gr CaCO3 = mol × Mr
= 60 mmol × 100
= 6000 mg
= 6 gram
Jadi, massa CaCO3 yang mengendap adalah 6 gram (A).
Perdalam materi ini di Pembahasan Kimia UN: Kelarutan dan Hasil Kali Kelarutan.
Soal No. 14 tentang Hidrolisis Garam
NH3 (aq) + HCl (aq) → NH4Cl (aq)
Senyawa tersebut dalam air mengalami hidrolisis dengan pH larutan sebesar …. (Kb NH3 = 10−5, Kw = 10−14)
A. 1 − log 5
B. 1 + log 5
C. 5 + log 1
D. 9 + log 1
E. 9 + log 5
Pembahasan
Suatu garam akan terhidrolisis apabila pereaksinya (asam dan basa pembentuknya) mempunyai nilai mol yang sama. Dari data pada soal diperoleh:
mol NH3 = mol HCl
= M × V
= 50 ml × 0,2 M
= 10 mmol
Karena semua koefisien dalam reaksi tersebut sama, mol NH4Cl juga sama dengan 10 mmol. Sedangkan volumenya merupakan volume gabungan, yaitu 50 ml + 50 ml = 100 ml. Sehingga molaritas garam tersebut adalah:
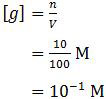
Garam NH4Cl berasal dari asam kuat dan basa lemah sehingga bersifat asam. Rumus hidrolisis garam yang bersifat asam adalah:
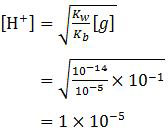
pH = −log [H+]
pH = −log 1×10−5
pH = 5 + log 1
Jadi, garam amonium klorida terhidrolisis dalam air dengan pH = 5 + log 1 (C).
Perdalam materi ini di Pembahasan Kimia UN: Hidrolisis Garam.
Soal No. 15 tentang Larutan Elektrolit dan Nonelektrolit
- C12H22O11 2 M
- CaCl2 2 M
- Ca(OH)2 2 M
- H2C2O4 2 M
Pasangan larutan yang diperkirakan mempunyai daya hantar listrik sama kuat terdapat pada nomor ….
A. (1) dan (3)
B. (1) dan (4)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (4)
Pembahasan
Suatu larutan dapat menghantarkan listrik apabila larutan tersebut merupakan larutan elektrolit. Larutan elektrolit di antaranya ditandai dengan adanya unsur logam dalam senyawanya.
Dengan demikian yang merupakan larutan elektrolit adalah CaCl2 dan Ca(OH)2 (mengandung logam Ca). Sedangkan C12H22O11 dan H2C2O4 adalah larutan nonelektrolit sehingga tidak dapat menghantarkan listrik.
Adanya nilai molaritas pada soal di atas tidak berpengaruh karena nilainya sama semua. Yang berpengaruh adalah banyaknya ion dalam senyawa tersebut.
CaCl2 mengandung 1 ion Ca2+ dan 2 ion Cl−, berarti ada 3 ion. Demikian juga dengan Ca(OH)2, mengandung 1 ion Ca2+ dan 2 ion OH−. Sehingga daya hantar listrik keduanya adalah sama kuat.
Jadi, pasangan larutan yang diperkirakan mempunyai daya hantar listrik sama kuat terdapat pada nomor 2 dan 3 (C).
Simak Pembahasan Soal Kimia UN 2015 selengkapnya.
Dapatkan pembahasan soal dalam file pdf di sini.
Terimakasih
Semoga Bermanfaat

