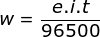Untuk Pembelajaran selanjutnya…
Soal No.1
Reaksi elektrolisis larutan yang menghasilkan gas H2 di katoda dan O2 di anoda jika menggunakan elektroda C, kecuali….
- larutan NaNO3
- larutan K2SO4
- larutan MgSO4
- larutan Cu(NO3)2
- larutan Ca(NO3)2
PEMBAHASAN :
Reaksi elektrolisis masing-masing pilihan
- larutan NaNO3
NaNO3 → Na+ + NO3–
K : 2H2O + 2e– → 2OH– + H2
A : 2H2O → 4H+ + 4e– + O2 - larutan K2SO4
K2SO4 → 2K+ + SO42-
K : 2H2O + 2e– → 2OH– + H2
A : 2H2O → 4H+ + 4e– + O2 - larutan MgSO4
MgSO4 → Mg2+ + SO42-
K : 2H2O + 2e– → 2OH– + H2
A : 2H2O → 4H+ + 4e– + O2 - larutan Cu(NO3)2
Cu(NO3)2 → Cu2+ + 2NO3–
K : Cu2+ + 2e– → Cu
A : 2H2O → 4H+ + 4e– + O2 - larutan Ca(NO3)2
Ca(NO3)2 → Ca2+ + 2NO3–
K : 2H2O + 2e– → 2OH– + H2
A : 2H2O → 4H+ + 4e– + O2
Maka reaksi yang tidak menghasilkan H2 di katoda dan O2 di anoda adalah reaksi elektrolisis Cu(NO3)2
Jawaban D
Soal No.2
Elektrolisis larutan KNO3 dengan elektroda grafit, reaksi yang terjadi di anode adalah….
- 4OH– → 2H2O + O2 + 4e–
- 4H+ + O2 +4e– → 2H2O
- Cu2+ + 2e– → Cu
- 2H2O → 4H+ + O2 + 4e–
- 2H2O + 2e– → 2OH– + H2
PEMBAHASAN :
Larutan KNO3 diionisasikan terlebih dahulu
KNO3 → K+ + NO3–
yang bereaksi di katoda dan di anoda adalah air
Katoda (-) : 2H2O + 2e– → 2OH– + H2
Anoda (+) : 2H2O → 4H+ + 4e– + O2
Jawaban D
Soal No.3
Massa logam Mg yang diendapkan di katoda jika larutan MgSO4 dielektrolisis menggunakan arus 4A selama 2.895 detik adalah….(Ar Mg = 24)
- 0,118 gram
- 0,59 gram
- 1,44 gram
- 5,9 gram
- 59 gram
PEMBAHASAN :
Menentukan massa Mg yang diendapkan menggunakan hukum Faraday I![]()
![]()
![]()
Jawaban C
Soal No.4
Elektrolisis larutan MSO4 pada katode terbentuk 0,28 gram logam M. Larutan hasil elektrolisis dapat dinetralkan oleh 50 mL larutan NaOH 0,2 M. Massa atom relatif unsur M adalah….
- 84
- 70
- 56
- 42
- 28
PEMBAHASAN :
Reaksi elektrolisis MSO4:
MSO4 → M2+ + SO42-
Katoda (-) : M2+ + 2e– → M
Anoda (+) : 2H2O → 4H+ + 4e– + O2
Samakan jumlah elektronnya sehingga menjadi:
Katoda (-) : 2M2+ + 4e– → 2M
Anoda (+) : 2H2O → 4H+ + 4e– + O2
Larutan di netralisasi oleh 50 mL larutan NaOH(basa) 0,2 M. Pada netralisasi berlaku:
mol H+ = mol OH–
mol H+ = b.Mb.Vb = 1. 0,2. 5 x 10-2 L = 0,01 mol
mol H+ ini merupakan H+ yang dihasilkan di anoda yaitu sebanyak 0,01 mol, maka Ar M bisa ditentukan dengan menentukan mol M dengan cara membandingkan koefisiennya dengan koefisien H+![]()
![]()
Menentukan Mr dari mol M![]()
Sehingga Ar:![]()
Jawaban C
Soal No.5
Eletrolisis larutan NaCl menghasilkan gas sebanyak 11,2 liter di katode pada keadaaan STP. Banyak muatan listrik yang mengalir dalam larutan NaCl adalah…
- 2,00 F
- 0,50 F
- 4,00 F
- 1,00 F
- 0,25 F
PEMBAHASAN :
Menentukan muatan listrik dalam faraday (F) sama dengan menentukan jumlah mol elektron (mol e). Mol elektron dapat ditentukan dari perbandingan koefisien dengan zat yang telah diketahui mol nya (gas di katode). Reaksi elektrolisisnya sebagai berikut:
NaCl → Na+ + Cl–
Katode (-) : 2H2O + 2e– → 2OH– + H2
Anode (+) : 2Cl– → Cl2 + 2e–
Gas yang dihasilkan di katode adalah H2.
Menentukan mol H2 dari volume dalam keadaan STP![]()
![]()
Bandingkan koefisien H2 dan elektron untuk menentukan mol elektron![]()
![]()
Jawaban D
Soal No.6
Dengan menggunakan arus listrik yang sama digunakan untuk mengelektrolisis larutan CuSO4 dan larutan AgNO3. Bila logam tembaga diendapkan sebanyak 17,5 gram, maka logam perak yang diendapkan adalah sebanyak…(Ar Ag = 108 dan Ar Cu = 63,5)
- 43,5 gr
- 45,7 gr
- 49,5 gr
- 59,5 gr
- 67,2 gr
PEMBAHASAN :
Jika menggunakan arus yang sama berlaku hukum Faraday II![]()


![]()
Jawaban D
Soal No.7
Elektrolisis leburan Al2O3 menghasilkan 0,225 gram Al. Muatan listrik yang diperlukan adalah…. (Ar O = 16, Ar Al = 27)
- 1.200 Coulomb
- 2.120,5 Coulomb
- 2.412,5 Coulomb
- 3.249 Coulomb
- 4.325,4 Coulomb
PEMBAHASAN :
Menentukan muatan (Q) bisa dihitung dari perkalian i.t dari rumusan![]()
![]()
![]()
Jawaban C
Soal No.8
Arus listrik sebesar 1 A di gunakan untuk mengelektrololisis suatu larutan asam yang berlangsung selama 8 menit. Jumlah mol gas yang dihasilkan di katode adalah….
- 0,005 mol
- 0,0025 mol
- 0,05 mol
- 0,25 mol
- 0,5 mol
PEMBAHASAN :
Karena diketahui arus dan waktunya. Maka kita bisa menentukan jumlah mol elektron atau Faraday.![]()
Reaksi elektrolisis di katode jika zatnya asam
Katode(-) : 2H+ + 2e– → H2
Menentukan mol H2 dari perbandingan koefisien dengan elektron![]()
![]()
Jawaban B
Soal No.9
Elektrolisis 200 mL CuSO4 1 M, jika ingin mengendapkan semua tembaga menggunakan arus sebesar 10 A maka waktu yang diperlukan adalah….(Ar Cu = 63,55)
- 193
- 360
- 1.930
- 3.860
- 9.650
PEMBAHASAN :
Menentukan Mol CuSO4
n = M x V = 1 M x 0,2 L = 0,2 mol
Jika mengalami ionisasi
CuSO4 → Cu2+ + SO42-
0,2 mol 0,2 mol
Dalam elektrolisis CuSO4 reaksi di katode:
Katode (-) : Cu2+ + 2e– → Cu
0,2 mol 0,4 mol![]()
![]()
Jawaban D
Soal No.10
Pada elektrolisis larutan Na2SO4 dengan elektroda Pt maka zat yang dihasilkan di anoda dan katoda adalah….
- H2O dan H2
- O2 dan H2
- H2 dan O2
- Na dan H2
- Na dan O2
PEMBAHASAN :
Reaksi elektrolisis larutan Na2SO4
Na2SO4 → 2Na+ + SO42-
Katoda(-) : 2H2O +2e → 2OH– + H2
Anoda(+) : 2H2O → 4H+ + 4e– + O2
Maka zat yang dihasilkan di anoda dan katoda adalah O2 dan H2
Jawaban B
Semoga Bermanfaat