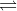Untuk Pembelajaran selanjutnya…
Soal No.11
Larutan jenuh L(OH)2 memiliki pH = 9. Hasil kali kelarutan (Ksp) dari L(OH)2 adalah….
- 10-10
- 5 x 10-11
- 10-15
- 5 x 10-16
- 10-10
PEMBAHASAN :
Menentukan [OH-] dari nilai pH = 9
pH = 9 maka nilai pOH = 14 – 9 = 5
Jadi [OH-] = 10-5
Reaki ionisasi L(OH)2
L(OH)2![]() L2+ + 2OH–
L2+ + 2OH–
5.10-6 10-5
(konsentrasi OH- sudah di ketahui, maka konsentrasi L2+ di dapat dari perbandingan dengan koefisien)
Ksp = [L2+][2OH–]2 = (5.10-6)(10-5)2 = 5. 10-16
Jawaban D
Soal No.12
Jika atom 4X dan 17Y berikatan maka bentuk molekul dan kepolarannya adalah….
- segi empat planar dan polar
- linier dan polar
- tetrahedral dan non polar
- oktahedral dan non polar
- linier dan non polar
PEMBAHASAN :
Untuk menentukan bentuk molekulnya maka kita bisa menentukannya lewat teori domain elektron, sebelumnya kita akan konfigurasi elektronnya untuk menentukan atom pusat dan senyawa yang terbentuk
4X : 1s2 2s2 (melepas 2e–) x 1
17Y : 1s2 2s2 2p6 3s2 3p5 (menangkap 1e–) x 2
Maka senyawa yang terbentuk adalah XY2 dengan X sebagai atom pusat (X jumlahnya lebih sedikit)
Di teori domain elektron ditentukan A (jumlah atom pusat), X (jumlah PEI), E (jumlah PEB), dari rumus senyawa dapat ditentukan:
A = 1
X = 2
E ditentukan lewat rumus:![]()
Karena E = 0 maka senyawa tersebut bersifat non polar karena tidak memiliki PEB
domain elektronnya:
AX2 yang memiliki bentuk linear.
Jawaban E
LIHAT JUGA : Soal Prediksi USBN Kimia Bag.1
Soal No.13
Bagan berikut menggambarkan larutan dengan berbagai konsentrasi…
Bagan yang menunjukkan tekanan uap larutan paling besar adalah…
PEMBAHASAN :
Menentukan larutan dengan tekanan uap larutan paling besar di tentukan dari jumlah mol partikel zat terlarut. Semakin banyak zat terlarut maka tekanan uap akan semakin kecil karena uap yang dihasilkan akan semakin sedikit akibat terhalang adanya zat terlarut yang sukar larut. Maka larutan yang tekanan uap yang paling besar adalah larutan dengan zat terlarut paling sedikit, yaitu larutan IV
Jawaban D
Soal No.14
Kabut adalah sistem koloid dari….
- gas dalam zat cair
- gas dalam zat padat
- zat cair dalam gas
- zat cair dalam zat cair
- gas dalam gas
PEMBAHASAN :
Untuk menentukan zat pendispersi dan zat terdispersi. Maka kita bisa menentukan wujud dominan yang ada dalam koloid tersebut. Kabut berbentuk gas namun di dalamnya terdapat zat cair. Sehingga kabut memiliki zat pendispersi gas dan zat terdispersi cair
Jawaban C
LIHAT JUGA : Soal Prediksi USBN Kimia Bag.3
Soal No.15
Pengetahuan tentang sifat koloid telah diterapkan pada kegiatan berikut:
(1) Penambahan polialumunium klorida pada pengolahan air minum
(2) Pemutihan gula tebu
(3) Pembentukan delta di muara sungai
(4) Proses cuci darah
(5) Pengobatan sakit perut dengan norit
Kegiatan yang menerapkan sifat koagulasi koloid adalah….
- (1) dan (3)
- (1) dan (2)
- (2) dan (4)
- (3) dan (5)
- (4) dan (5)
PEMBAHASAN :
Koagulasi koloid merupakan proses penggumpalan koloid yang disebabkan oleh pelucutan muatan koloid akibat dimasukan kedalam zat elektrolit. Koagulasi terjadi pada peristiwa penambahan polialumunium klorida pada pengolahan air minum dan pembentukan delta di muara sungai. Akibat dari pelucutan muatan dari koloid maka antar koloid tidak terjadi tolak menolak antar muatan yang sama sehingga antar koloid akan saling bergabung dan terpengaruhi oleh gaya gravitasi dan mengumpul di bawah. Pemutihan gula tebu dan pengobatan sakit perut dengan norit merupakan contoh sifat koloid yaitu adsorpsi sedangkan proses cuci darah merupakan proses dialisis.
Jawaban A
Soal No.16
Diketahui persamaan termokimia sebagai berikut
S(s) +O2(g) → SO2(g) ΔH = -296,8 kJ
SO2(g) + 1/2O2(g) → SO3(g) ΔH = -99,2 kJ
Berdasarkan data tersebut, perubahan entalpi pembentukan gas SO3 adalah….
- -98,4 kJ
- 197,6 kJ
- -197,6 kJ
- 395,0 kJ
- -396,0 kJ
PEMBAHASAN :
Reaksi pembentukan gas SO3 adalah sebagai berikut:
S(s) + 3/2 O2(g) → SO3(g)
Untuk menentukan ΔH nya, bisa menggunakan Hukum Hess dari kedua reaksi yang telah diketahui ΔH nya, agar ketika dijumlahkan kedua reaksi tersebut harus diubah menjadi:
Reaksi I (Tetap) : S(s) +O2(g) → SO2(g) ΔH = -296,8 kJ
Reaksi II (Tetap): SO2(g) + 1/2O2(g) → SO3(g) ΔH = -99,2 kJ + (SO2 di reaksi I dan II dapat dicoret)
S + 3/2 O2 → SO3 ΔH = -296,8 + (-99,2) kJ = -396 kJ
Jawaban E
Soal No.17
Sebanyak 100 mL larutan HCl 1 M direaksikan dengan 100 mL larutan NaOH 1 M dalam suatu kalorimeter. Suhu larutan naik dari 29 oC menjadi 37,5 oC. Jika kalor jenis larutan dianggap sama dengan kalor jenis air, yaitu 4,2 J/g oC dan massa jenis larutan = 1 g/cm3, maka perubahan entalpi reaksi HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l) adalah….
- 82,3 kJ/mol
- 71,4 kJ/mol
- -71,4 kJ/mol
- -54,6 kJ/mol
- -45,9 kJ/mol
PEMBAHASAN :
Menentukan ΔHr melalui cara percobaan menggunakan rumusan:
m = (va + vb).ρ = (100 + 100)ml. 1 g/cm3 = 200 gr
qr = -(qs + qk) = -(m.c.ΔT + C. ΔT) = -(200.4,2.(37,5-29) + 0.(37,5-29))
qr = – (7.140) J = – 7,14 kJ
Menentukan mol air hasil reaksi netralisasi
nHCl = M x V = 1 M x 100 mL = 100 mmol
nNaOH = M x V = 1 M x 100 mL = 100 mmol
HCl + NaOH → NaCl + H2O
m 100 100 – –
r 100 100 – 100 100 +
s – – 100 100
nH2O = 100 mmol = 0,1 mol
Soal No.18
Dari data suatu reaksi: N2(g) + 3H2(g) → 2NH3(g)
rumus laju reaksi adalah….
- v = k [N2][H2]3
- v = k [N2][H2]2
- v = k [N2][H2]
- v = k [N2]2[H2]
- v = k [N2]2[H2]2
PEMBAHASAN :
Menentukan rumus laju reaksi harus terlebih dahulu menentukan orde masing-masing pereaksi:
Menentukan orde N2
Cari 2 [H2] yang sama yaitu percobaan 1 dan 2, kemudian bandingkan [N2] di percobaan 1 dan 2 terhadap laju reaksi![]()
![]()
![]()
x = 1
Menentukan orde H2
Cari 2 [N2] yang sama yaitu percobaan 2 dan 3, kemudian bandingkan [H2] di percobaan 2 dan 3 terhadap laju reaksi![]()
![]()
![]()
y = 1
Maka rumus laju reaksinya adalah v = k[N2][H2]
Jawaban C
Soal No.19
Faktor yang dapat memperbesar pembentukan PCl5 adalah….
- volume diperbesar
- tekanan diperbesar
- suhu diturunkan
- katalis ditambahkan
- pereaksi dikurangi
PEMBAHASAN :
Memperbesar pembentukan PCl5 atau reaksi digeser ke kanan dapat di lakukan dengan cara sebagai berikut:
- Penambahan konsentrasi PCl3 atau penambahan konsentrasi Cl2. Karena dengan penambahan konsntrasi maka reaksi akan bergeser menjauhi zat yang di tambah atau menuju ke PCl5.
- Pengurangan konsentrasi PCl5 karena dengan pengurangan konsentrasi maka reaksi akan mendekati zat yang dikurangi konsntrasinya.
- Volume diperkecil karena dengan diperkecil maka reaksi akan bergeser ke jumlah koefisien yang kecil yaitu menuju ke PCl5 karena bagian kanan jumlah koefisiennya lebih kecil.
- Tekanan diperbesar karena dengan diperbesar maka reaksi akan bergeser ke jumlah koefisien yang kecil yaitu menuju ke PCl5 karena bagian kanan jumlah koefisiennya lebih kecil.
- Suhu dinaikan karena dengan dinaikan maka reaksi akan bergeser menuju reaksi endoterm, dimana reaksi ke kanan merupakan reaksi endoterm karena dikanan ΔH bertanda positif atau endoterm
Maka jawaban yang tepat adalah B
Jawaban B
Soal No.20
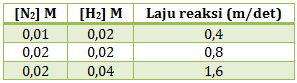
Jika dalam volum 5 L terdapat 4 mol asam iodida, 0,5 mol iodine dan 0,5 mol hidrogen dalam kesetimbangan pada suhu tertentu, maka tetapan kesetimbangan untuk reaksi pembentukan asam iodide dari iodine dan hidrogen adalah….
PEMBAHASAN :
Karena sudah dalam keadaan setimbang maka nilai mol tinggal dimasukan ke dalam rumusan Kc yang kemudian harus dibagi volume karena dalam rumusan dalam bentuk konsentrasi, reaksinya:
H2 + I2![]() 2HI
2HI![]()
Jawaban E
Semoga Bermanfaat