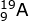Untuk Pembelajaran selanjutnya…
Informasi berikut digunakan untuk mengerjakan soal no 1 s.d 2
Perhatikan notasi atom 2 buah unsur berikut:
Soal No.1
Diagram orbital yang paling tepat untuk elektron terakhir dari unsur B adalah…(Nomor atom Ne = 10, Ar = 18)
PEMBAHASAN :
Untuk menentukan konfigurasi digunakan nomor atom yang menunjukan jumlah elektron, Jumlah elektron atom B adalah 17. Jika disingkat menggunakan gas mulia maka menggunakan atom Ne karena nomor atomnya lebih kecil dari 17. Maka sisanya tinggal 7 elektron lagi. Kelanjutan dari Ne adalah 3s dan 3p. Jika sisa 7 elektron dimasukan maka konfigurasinya menjadi:
17Cl : ![]()
Jawaban B
Soal No.2
Unsur A dalam sistem periodik terletak pada….
- golongan VII A, periode 2
- golongan I A, periode 3
- golongan VII A, periode 3
- golongan I B, periode 3
- golongan I A, periode 2
PEMBAHASAN :
Unsur A memiliki jumlah elektron = 9 elektron, jika dikonfigurasikan menjadi:
9A : 1s2 2s2 2p5
Elektron berakhir di sub kulit P artinya termasuk golongan A. Golongan ditentukan dari elektron valensi atau elektron di kulit terakhir. Kulit terakhir adalah kulit 2 dengan jumlah elektron 2 + 5 = 7, maka golongnnya adalah VII A. Sedangkan periode dilihat dari jumlah kulit. Jumlah kulitnya adalah 2 maka periodenya adalah 2.
Jawaban A
LIHAT JUGA : Soal Prediksi USBN Kimia Bag.2
Soal No.3
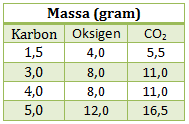
Perhatikan tabel percobaan reaksi pembentukan gas CO2 dari karbon dan oksigen berikut ini
Berdasarkan tabel perbandingan massa C dan O dalam senyawa CO2 adalah…
- 1 : 3
- 1 : 4
- 3 : 1
- 3 : 8
- 4 : 1
PEMBAHASAN :
Cara mudah menentukan perbandingan C dan O dalam CO2 (Hukum perbandingan tetap Proust) adalah dari perbandingan Ar x jumlah atom masing-masing atom. Namun jika tidak diketahui Ar nya, cara mudahnya menggunakan bantuan hukum kekekalan massa (Lavoisier). Jika dijumlahkan massa karbon dan massa oksigen jika hasilnya sama dengan massa CO2 maka itulah perbandingannya. Percobaan 1 dan 2 penjumlahan massa C + massa O = massa CO2. Jika dibulatkan dan disederhanakan maka perbandingan dari percobaan 1 dan 2 adalah 3 : 8
Jawaban D
LIHAT JUGA : Soal Prediksi USBN Kimia Bag.3
Soal No.4
50 g kalium karbonat direaksikan dengan 100 mL asam klorida 5 M dengan reaksi,
CaCO3(s) + 2HCl(aq) → CaCl2(aq) + H2O(l) + CO2(g)
Massa zat yang tersisa dan volume gas CO2 yang dihasilkan jika diukur pada kondisi STP adalah….(Mr CaCO3 = 100, Mr HCl = 36,5)
- 2,5 g CaCO3 dan 5,6 L CO2
- 25 g CaCO3 dan 5,6 L CO2
- 25 g CaCO3 dan 11,2 L CO2
- 36,5 g HCl dan 22,4 L CO2
- 18,25 g HCl dan 5,6 L CO2
PEMBAHASAN :
Menentukan mol kalsium karbonat![]()
Menentukan mol HCl
n = M x V = 5 M x 100 ml = 500 mmol = 0,5 mol
CaCO3(s) + 2HCl(aq) → CaCl2(aq) + H2O(l) + CO2(g)
m 0,5 0,5 – –
r 0,25 0,5 – 0,25 0,25 0,25 +
s 0,25 – 0,25 0,25 0,25
Zat yang tersisa adalah CaCO3, Menentukan massa CaCO3 yag tersisa:![]()
Gr = n x Mr = 0,25 mol x 100 = 25 gram
Menentukan Volume CO2 pada keadaan STP yang dihasilkan![]()
V = n x 22,4 = 0,25 x 22,4 = 5,6 L
Jawaban B
Soal No.5
Data hasil pengujian zat dengan alat uji elektrolit
Pernyataan yang benar berdasarkan hasil percobaan tersebut adalah….
- larutan A dan B elektrolit kuat
- larutan C elektrolit lemah
- zat A daya hantar listriknya sama dengan zat D
- larutan B daya hantar listriknya lebih lemah dibanding zat E
- larutan B daya hantar listriknya lebih kuat dari A dan D
PEMBAHASAN :
Ciri-ciri larutan elektrolit kuat, elektrolit lemah atau non elektrolit berdasarka uji elektrolit
Dari ciri di atas zat A merupakan elektrolit kuat, zat B elektrolit lemah, zat C non elektrolit. Sedangkan zat D merupakan senyawa ion yang dapat menghantarkan listrik dalam bentuk lelehannya. Sedangkan zat E tidak dapat diketahui sifatnya karena semua larutan elektrolit dan non elektrolit jika dalam bentuk padat tidak dapat menghantar listrik. Maka jawaban yang tepat adalah C. Zat A dan zat D keduanya merupakan zat elektrolit kuat
Jawaban C
Soal No.6
Hasil pengujian pH sampel air limbah menggunakan tiga larutan indikator adalh sebagai berikut:
Nilai pH sampel A dan B berturut-turut….
- pH ≤ 4,2 dan pH ≥ 10
- 4,2 ≤ pH ≤ 6,0 dan 7,6 ≤ pH ≤ 8,0
- 4,2 ≤ pH ≤ 6,0 dan pH ≥ 10
- 7,6 ≤ pH ≤ 8,0 dan pH ≤ 4,2
- 4,2 ≤ pH ≤ 6,0 dan 6,0 ≤ pH ≤ 8,0
PEMBAHASAN :
Sampel A
- Dengan metil merah berwarna merah artinya pH ≥ 6,3
- Dengan bromtimol biru berwarna biru artinya pH ≥ 7,6
- Dengan fenolftalein tidak berwarna artinya pH ≤ 8
Jika dibuat persamaan garisnya: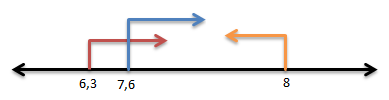
Sehingga ph nya:
7,6 ≤ pH ≤ 8
Sampel B
- Dengan metil merah berwarna merah artinya pH ≤ 4,2
- Dengan bromtimol biru berwarna biru artinya pH ≤ 6
- Dengan fenolftalein tidak berwarna artinya pH ≤ 8
Jika dibuat persamaan garisnya: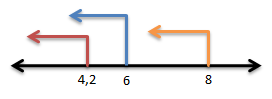
maka pH nya : pH ≤ 4,2
Jawaban D
Soal No.7
Konsentrasi asam cuka pada label botol di laboratorium kurang jelas, untuk mengetahuinya dilakukan titrasi dengan menggunakan larutan NaOH 0,1 M datanya sebagai berikut
Berdasarkan data tersebut, konsentrasi asam cuka adalah….
- 7. 10-2 M
- 8. 10-2 M
- 9. 10-2 M
- 1. 10-1 M
- 8. 10-1 M
PEMBAHASAN :
Titrasi saat titik ekuivalen berlaku:
mol H+ = mol OH–
a.Ma.Va = b.Mb.Vb (a = valensi asam/jumlah H+, b = valensi basa/jumlah OH–)
1.Ma.10 ml = 1. 0,1 M . ![]()
![]()
Jawaban B
Soal No.8
Campuran larutan berikut ini yang membentuk larutan penyangga adalah….
- 50 mL CH3COOH 0,2 M + 50 mL NaOH 0,1 M
- 50 mL CH3COOH 0,2 M + 100 mL NaOH 0,1 M
- 50 mL HCl 0,2 M + 100 mL NH3 0,1 M
- 50 mL HCl 0,2 M + 50 mL NH3 0,1 M
- 50 mL HCl 0,2 M + 50 mL NaOH 0,1 M
PEMBAHASAN :
Cara menentukan larutan penyangga atau bukan bisa dengan mereaksikannya kemudian menggunakan metode m,r,s jika yang lemah bersisa maka dipastikan membentuk larutan penyangga. Cara cepat menentukan penyangga atau bukan bisa juga dilihat dari jumlah H dari dan OH dari basa. Jika sama maka mol dari yang lemah harus lebih besar agar bisa bersisa untuk membentuk larutan penyangga. menentukan mol jika diketahui molaritas dan volume menggunakan rumus:
n = MxV
- CH3COOH (As.L) 10 mmol + NaOH (B.K) 5 mmol = Penyangga,karena mol asam lemah lebih besar dibanding basa kuat
- CH3COOH (As.L) 10 mmol + NaOH (B.K) 10 mmol = bukan penyangga karena molnya sama
- HCl (As.K) 10 mmol + NH3 (B.L) 10 mmol = bukan penyangga karena molnya sama
- HCl (A.K) 10 mmol + NH3 (B.L) 5 mmol = bukan penyangga karena asam kuat lebih besar molnya
- HCl (A.K) 10 mmol + NaOH (B.K) 5 mmol = bukan penyangga karena keduanya bersifat kuat
Jawaban A
Soal No.9
Senyawa yang mengalami hidrolisis total dalam air adalah….
- NH4Cl
- CH3COONa
- Na2SO4
- Al2S3
- MgSO4
PEMBAHASAN :
Hidrolisis terjadi antara air dengan ion yang berasal dari asam lemah atau basa lemah. Jika garam berasal dari asam lemah atau basa lemah. Maka garam tersebut akan terhidrolisis. Hidrolisis total terjadi pada garam yang berasal dari asam lemah dan basa lemah. Garam yang dimaksud adalah Al2S3 yang berasal dari basa lemah Al(OH)3 dan H2S (asam lemah)
Jawaban D
Soal No.10
Kelarutan Mg(OH)2 dalam NaOH 0,1 M dengan Ksp Mg(OH)2 = 1,8 x 10-11 mol2 L-3 adalah….
- 1,8 x 10-13 mol/L
- 1,8 x 10-10 mol/L
- 4,5 x 10-10 mol/L
- 1,8 x 10-9 mol/L
- 6,7 x 10-6 mol/L
PEMBAHASAN :
Menentukan kelarutan Mg(OH)2 dalam larutan NaOH berarti adanya ion senama yaitu OH– yang ada di Mg(OH)2 dan di NaOH.
Reaksi ionisasi NaOH
NaOH → Na+ + OH–
0,1 M 0,1 M 0,1 M
Reaksi Mg(OH)2
Mg(OH)2![]() Mg2+ + 2OH–
Mg2+ + 2OH–
s s (2s + 0,1 M)
(0,1 M berasal dari NaOH, karena adanya ion senama menyebabkan s kecil maka 2s menjadi di abaikan
Perhitungan kelarutan Mg(OH)2
Ksp = [Mg2+][2OH–]2
1,8 x 10-11 = s. 0,1![]()
Jawaban B
Semoga Bermanfaat