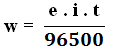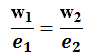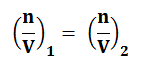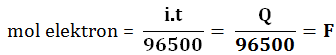Untuk Pembelajaran selanjutnya…
ELEKTROKIMIA
|
SEL VOLTA |
SEL ELEKTROLISIS |
|
Mengubah reaksi kimia menjadi energi listrik Terdapat dua elektroda: Katoda (+) : mengalami reaksi reduksi Anoda (-) : mengalami reaksi oksidasi Contoh: Baterai, Accu |
Mengubah energi listrik menjadi reaksi kimia Terdapat dua elektroda: Katoda (-) : mengalami reaksi reduksi Anoda (+) : mengalami reaksi oksidasi Contoh : Penyepuhan, pelapisan logam |
SEL VOLTA
DERET VOLTA
Li-K-Ba-Ca-Na-Mg-Al-Mn-(H2O)-Zn-Cr-Fe-Cd-Co-Ni-Sn-Pb-(H)-Cu-Hg-Ag-Pt-Au
Semakin Ke kiri: Semakin Ke kanan :

PENENTUAN EOSEL
ESEL = EO REDUKSI – EO OKSIDASI
PENENTUAN NOTASI SEL
Anoda I Ion Anoda II Ion Katoda I katoda
REAKSI PENDESAKAN
LOGAM DI KIRI DERET VOLTA DAPAT MENDESAK/BEREAKSI LOGAM DI KANAN DERET VOLTA
LIHAT JUGA : Video Pembelajaran Sel Volta
KOROSI
- Merupakan suatu reaksi oksidasi yang ditimbulkan akibat adanya gas oksigen dan air.
- Proses pencegahan terjadinya korosi:
1. Pelapisan (dilapisi dengan logam yang lebih susah mengalami oksidasi atau yang memiliki E yang lebih besar/berada di sebelah kanan logam yang akan dilindungi dalam deret volta)2. Proteksi Katodik (dihubungkan dengan logam yang lebih mudah teroksidasi yang memiliki E yang lebih kecil/berada di sebelah
kiri logam yang akan dicegah mengalami korosi)
3. Pengecatan (melindungi logam agar tidak bersentuhan dengan udara atau air
4.Aliasi (mencampurkan dengan logam lain sehingga memiliki sifat tahan karat)
LIHAT JUGA : Contoh Soal & Pembahasan Sel Volta
ELEKTROLISIS
Proses elektrolisis mengubah energi listrik menjadi reaksi kimia. Reaksi kimia yang terjadi yaitu reaksi ionisasi larutan elektrolit yang menghasilkan ion positif yang akan bergerak ke katoda (-) dan ion negatif yang akan bergerak ke anoda(+), contoh:
HCl(aq) → H+(aq) + Cl–(aq)
Ke katoda ke anoda
|
REAKSI PADA KATODA |
REAKSI PADA ANODA |
|
A. LARUTAN
|
A. Elektrode Inert (Pt, C, Au)
B. Elektrode Non Inert Elektrodenya yang akan bereaksi L → Ln+ + ne |
LIHAT JUGA : Contoh Soal & Pembahasan Elektrolisis & Faraday
HUKUM FARADAY
Faraday I :
-
Michael Faraday menemukan hubungan kuantitatif antara massa zat yang dibebaskan pada elektrolisis dengan jumlah listrik yang digunakan.
-
Rumus menentukan massa yang diendapkan:
w = massa yang dibebaskan (gram)
e = berat ekivalen = Ar / Jumlah elektron
i = arus listrik (ampere);
t = waktu (sekon)
Faraday II :
LIHAT JUGA : Video Pembelajaran elektrolisis & Faraday
Stoikiometri Faraday :
- Melibatkan perbandingan mol antar zat dalam reaksi elektrolisis
- Hal yang perlu diingat:
Perbandingan Mol = Perbandingan Koefisien
Pada P dan T berlaku :
- Langkah-langkah pengerjaan soal stoikiometri Faraday:
- Tulis reaksi elektrolisisnya
-
Ubah data yang diketahui ke mol jika diketahui Gr, V, M, JP, P, T dan jika data yang
diketahui arus (I), waktu (t), muatan (Q) ubah data ke mol elektron
- Bandingkan mol yang diketahui dengan mol zat yang akan ditanyakan.
- Ubah mol yang ditanyakan ke bentuk yang yang ditanyakan.
Semoga Bermanfaat