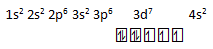Untuk Pembelajaran selanjutnya…
Soal No.1 (SBMPTN 2018)
Energi ionisasi (kJ/mol) ke-1 sampai ke-5 untuk unsur X berturut-turut adalah 786, 1.580, 3.230, 4.360, dan 16.010. Senyawa yang dapat terbentuk dan stabil adalah….
PEMBAHASAN :
Energi ionisasi adalah energi yang diperlukan untuk melepaskan elektron. Semakin tinggi energi ionisasi maka semakin sulit melepas elektron. Pada energi ionisasi ke lima kenaikannya terlalu drastis. Sehingga dapat diperkirakan atom tersebut mampu melepas elektron sampai melepaskan 4 e sedangkan untuk melepaskan atom yang ke 5 terlalu sulit karena energi ionisasinya terlalu besar. Maka ion yang paling mungkin adalah X4+ jika di ikatkan dengan Cl– akan membentuk senyawa XCl4
Jawaban E
Soal No.2 (SBMPTN 2016)
Nilai energi pengion ke-1 sampai ke-5 untuk unsur X pada golongan utama berturut-turut adalah 509, 979, 3.300, 4.400, dan 5.700 kJ.mol-1. Berdasarkan data tersebut, dapat disimpulkan bahwa unsur X cenderung membentuk ion….
PEMBAHASAN :
Energi pengion merupakan energi yang diperlukan untuk melepaskan elektron. Semakin tinggi energi ionisasi maka semakin sulit melepas elektron. Pada energi ionisasi ke tiga mengalami kenaikan lebih tinggi. Sehingga dapat diperkirakan atom tersebut mampu melepas elektron sampai 2 e sedangkan untuk melepaskan atom yang ke 3 terlalu sulit karena energi ionisasinya terlalu besar. Maka ion yang paling mungkin adalah X2+
Jawaban B
Soal No.3 (SBMPTN 2014)
Jika suatu unsur L memiliki nomor atom 27 dan nomor massa 58 maka pernyataan yang benar tentang unsur tersebut adalah ….
- L adalah logam transisi yang berada pada periode yang sama dengan unsur K
- L memiliki jumlah proton 27, neutron 27, dan elektron 31
- L termasuk unsur logam alkali tanah, periode 4, dan bisa membentuk basa L(OH)2
- L termasuk unsur nonlogam, periode 4 dan berada pada golongan yang sama dengan 45Rh
- L termasuk unsur logam alkali, periode 4 dan bersifat reduktor kuat
PEMBAHASAN :
- Konfigurasi unsur 27L :[Ar] 4s2 3d7
terletak pada periode 4. Sedangkan K konfigurasinya
19K : [Ar] 4s1
terletak pada periode keempat - Jumlah nomor atom = proton = elektron = 27
- Dari konfigurasi termasuk golongan VIIIB (transisi) periode 4 termasuk unsur logam
Pernyataan yang benar adalah pilihan A
Jawaban A
Soal No.4 (SPMB 2002)
Unsur dengan keelektronegatifan tinggi mempunyai konfigurasi elektron pada keadaan dasar adalah …
- 1s2 2s2 2p1
- 1s2 2s2 2p6 3s1
- 1s2 2s2 2p6 3s2 3p5
- 1s2 2s2 2p6 3s2 3p6
- 1s2 2s2 2p6 3s2 3p6 3d10 4s1
PEMBAHASAN :
Unsur yang memiliki keelektronegatifan tinggi yaitu unsur yang menangkap sedikit elektron untuk mencapai kestabilan.
- e.v = 3 (melepas 3e)
- e. v = 1 (melepas 1e)
- e.v = 7 (menangkap 1e)
- e.v = 8 (sudah stabil)
- e.v = 11 (transisi, melepas e)
Unsur yang paling tinggi keelektronegatifannya adalah pilihan C
Jawaban C
Soal No.5 (UMPTN 1990)
Bagi unsur dengan konfigurasi elektron sebagai berikut:
1s2 2s2 2p6 3s2 3p6 3d7 4s2
berlaku pernyataan bahwa unsur tersebut…
- Mempunyai nomor atom 27
- Terletak pada periode 4
- Mempunyai 3 elektron tidak berpasangan
- Termasuk dalam golongan alkali tanah
PEMBAHASAN :
- jika dijumlahkan elektronnya = 2 + 2 + 6 + 2 + 6 + 7 + 2 = 27, maka benar nomor atomnya =27
- Karena kulit terluarnya berada pada kulit 4, maka benar periodenya = 4
- jika di tuliskan diagram orbitalnya
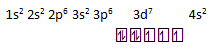
Maka benar jumlah elektron tidak berpasangannya ada 3 - Dari konfigurasi golongannya melibatkan sub kulit d yang tidak penuh maka golongan termasuk ke dalam logam transisi atau golongan B, yaitu golongan VIII B, jadi sala termasuk golongan alkali tanah
Maka jawaban yang benar adalah 1,2 dan 3
Jawaban A
Soal No.6 (SIMAK UI 2015)
Atom atau ion yang kulit terluarnya bukan ns2np3 dari atom-atom di bawah ini adalah … .
- N
- P
- Br2+
- C–
- Pb+
PEMBAHASAN :
- N : 1s2 2s2 2p3
- 15P : 1s2 2s2 2p6 3s2 3p3
- 35Br : [Ar] 4s2 3d10 4p5
35Br2+ : [Ar] 4s2 3d10 4p3 - 6C : 1s2 2s2 2p2
6C– : 1s2 2s2 2p3 - 82Pb : [Xe]6s2 4f14 5d10 6p2
82Pb+ : [Xe]6s2 4f14 5d10 6p1
Ion yang bukan termasuk ns2 np3 adalah Pb+
Jawaban E
Soal No.7 (SIMAK UI 2013)
Di antara unsur-unsur 4P, 19Q, 13R, 31S, 15T, 34U dan 53V, yang terletak dalam golongan yang sama pada sistem periodik adalah ….
- P dan R
- Q dan S
- Q dan V
- R dan S
- T dan U
PEMBAHASAN :
Konfigurasi masing-masing unsur:
4P : 1s2 2s2, e.v = 2 Þ Gol = II A
19Q : [Ar] 4s1, e.v = 1 Þ Gol = IA
13R : [Ne] 3s2 3p1, e.v = 3 Þ Gol = IIIA
31S : [Ar] 4s2 3d10 4p1, e.v = 3 Þ Gol = IIIA
15T : [Ne] 3s2 3p3, e.v = 5 Þ Gol = VA
34U : [Ar] 4s2 3d10 4p4, e.v = 6 Þ Gol = VIA
53V : [Kr] 5s2 4d10 5p5, e.v = 7 Þ Gol = VIIA
Pasangan unsur yang satu golongan adalah R dan S
Jawaban D
Soal No.8 (UM UGM 2008)
.Pernyataan yang benar
tentang unsur-unsur tersebut adalah ….
- unsur B memiliki jari-jari atom terbesar
- potensial ionisasi unsur D adalah yang terbesar
- unsur A lebih elektronegatif daripada unsur B
- elektronegatifitas unsur D adalah yang terbesar
PEMBAHASAN :
Menentukan golongan dan periode masing-masing unsur
8A : 1s2 2s2 2p4, Gol = VIA, Periode : 2
16B : 1s2 2s2 2p6 3s2 3p4, Gol = VIA, Periode : 3
17C : 1s2 2s2 2p6 3s2 3p5, Gol = VIIA, Periode : 3
18D : 1s2 2s2 2p6 3s2 3p6, Gol = VIIIA, Periode : 3
- Sifat jari-jari atom dalam satu golongan dari atas ke bawah semakin besar, dalam satu periode dari kiri ke kanan semakin kecil. Unsur yang paling besar jari-jarinya yang paling kiri dan paling bawah yaitu unsur B
- Sifat potensial ionisasi dalam satu golongan dari atas ke bawah semakin kecil, dalam satu periode dari kiri ke kanan semakin besar. Unsur yang paling besar potensial ionisasinya yang paling kanan dan paling atas yaitu unsur D
- Kecenderungan elektronegatif sama dengan potesial ionisasi sehingga unsur A akan lebih elektronegatif dibanding unsur B.
- Keelektronegatifan terbesar adalah unsur paling kanan yaitu golongan VIIIA. Tetapi, karena golongan VIIIA sudah stabil maka tidak memiliki ketertarikan terhadap elektron maka golongan VIIIA tidak memiliki keelektronegatifan.
Jawaban yang paling tepat adalah 1,2 dan 3
Jawaban A
Soal No.8 (UM UNDIP 2009)
Diketahui 5 unsur berikut:
Unsur yang mempunyai jari-jari atom terbesar adalah….
PEMBAHASAN :
Menentukan terlebih dahulu Golongan dan Periode masing-masing unsur
 : 1s2 2s2 2p1, Golongan IIIA periode 2
: 1s2 2s2 2p1, Golongan IIIA periode 2 : 1s2 2s2 2p6 3s2 , Golongan IIA periode 3
: 1s2 2s2 2p6 3s2 , Golongan IIA periode 3-
 : 1s2 2s2 2p6 3s2 3p4 , Golongan VIA periode 3
: 1s2 2s2 2p6 3s2 3p4 , Golongan VIA periode 3  : 1s2 2s2 2p6 3s2 3p6 4s1 , Golongan IA periode 4
: 1s2 2s2 2p6 3s2 3p6 4s1 , Golongan IA periode 4 : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5 , Golongan VIIA periode 4
: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5 , Golongan VIIA periode 4
Dari konfigurasi dan letak Golongan dan periode unsur yang jari-jarinya paling besar adalah K, karena kecenderungan jari-jari atom dalam SPU dalam satu periode dari kiri ke kanan makin kecil artinya golongan IA jari-jarinya paling besar.
Jawaban D
Soal No.9 (UM UNDIP 2009)
Energi ionisasi unsur ![]() lebih besar dari pada unsur
lebih besar dari pada unsur ![]() .
.
SEBAB
Unsur golongan VA lebih stabil daripada unsur golongan VI A
PEMBAHASAN :
Pernyataan benar, karena ![]() memiliki konfigurasi elektron yang stabil (setengah penuh) dibanding
memiliki konfigurasi elektron yang stabil (setengah penuh) dibanding ![]() , jika dikonfigurasikan
, jika dikonfigurasikan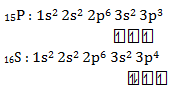
Karena lebih stabil maka P (Golongan VA) memiliki energi ionisasi yang lebih tinggi dibanding S (Golongan VI A). Alasan BENAR tapi tidak berhubungan
Jawaban B
Soal No.10 (UM UNDIP 2009)
Elektron terakhir dari suatu atom menempati bilangan kuantum n = 3, l = 1, m = 0, s = 1/2. Dalam tabel periodik unsur tersebut terletak pada….
- Golongan VA, periode 2
- Golongan IVA, periode 3
- Golongan VIIA, periode 2
- Golongan VIIA, periode 3
- Golongan VIIIA, periode 2
PEMBAHASAN :
Bilangan kuantum elektron terakhir terletak pada n = 3, l = 1, m = 0, s = 1/2, jika digambarkan diagram orbitalnya![]()
atau terakhir pada 3p2, jika dituliskan konfigurasi lengkapnya : 1s2 2s2 2p6 3s2 3p2
Maka letaknya yaitu pada golongan IVA dan periode = 3
Jawaban B
Semoga Bermanfaat