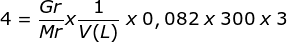Untuk Pembelajaran selanjutnya…
Soal No.1 (UTBK 2019)
Dibawah ini menunjukkan fenomena yang dapat diamati dalam kehidupan sehari-hari. Dari fenomena berikut, yang tidak menunjukkan sifat koligatif adalah…
- Titik beku air menurun ketika ditambahkan garamnya
- Lobster akan mati jika disimpan dalam air tawar
- Zat anti beku ditambahkan ke dalam radiator untuk menjaga mesin mobil agar tetap dingin
- Pada daerah pegunungan, waktu untuk memasak spageti menjadi lebih lama
PEMBAHASAN :
- Titik beku air menurun ketika ditambahkan garamnya sesuai prinsip penurunan titik beku dimana jika pelarut ditambahkan zat terlarut maka titik beku akan mengalami penurunan
- Lobster laut akan mati jika disimpan dalam air tawar. Ini merupakan pengaruh tekanan osmosis yang berbeda antara air laut dan air tawar. Hal ini merupakan fenomena sifat koligatif tekanan osmosis
- Zat anti beku ditambahkan ke dalam radiator untuk mejaga mesin mobil agar tetap dingin sesuai dengan prinsip penurunan titik beku
- Pada daerah pegunungan waktu untuk memasak spageti menjadi lebih lama seharusnya memasak di pegunungan memasak air akan lebih cepat karena daerah pegunungan tekanan udaranya lebih rendah
Jawaban D
Soal No.3 (SBMPTN 2017)
Sebanyak 8 g elektrolit kuat L2X dilarutkan dalam 1 L air. Jika tekanan osmosis larutan ini 4 atm pada 27 oC (R = 0,082 L.atm.mol-1. K-1). Mr L2X adalah…
PEMBAHASAN :
Diketahui:
Gr = 8 gram
Elektrolit kuat L2X, maka jumlah ionnya (n) = 3
π = 4 atm
T = 27 oC = 300 K
R = 0,082
V = 1 L air (penambahan volume zat terlarut diabaikan)
Menentukan Mr dari tekanan osmosis
π = M. R.T .i![]()
![]()
Jawaban D
Soal No.4 (SBMPTN 2016)
Larutan A dibuat dengan melarutkan 0,01 mol urea dalam 500 g air. Larutan B dibuat dengan melarutkan 0,001 mol NaBr dan 0,001 mol Na2SO4 dalam 500 g air. Kedua garam ini terdisosiasi sempurna dalam air. Perbandingan penurunan titik beku larutan A terhadap larutan B adalah….
- 2 : 3
- 1 : 2
- 1 : 1
- 3 : 2
- 2 : 1
PEMBAHASAN :
Diketahui:
mol urea = 0,01 mol
P air yang dilarutkan urea = 500 gr = 0,5 kg
mol NaBr = 0,001 mol
mol Na2SO4 = 0,001 mol
P air yang dilarutkan NaBr + Na2SO4 = 500 gr = 0,5 kg
terdisosiasi sempurna artinya elektrolit kuat, maka
jumlah ion NaBr (n) = 2
jumlah ion Na2SO4 (n) = 3
Menetukan perbandingan penurunan titik beku kedua larutan![]()
Kf di coret karena nilainya sama untuk pelarut yang sama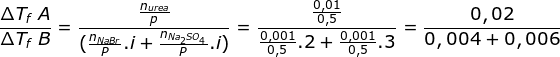
![]()
Jawaban E
Soal No.5 (SBMPTN 2015)
Tetapan kenaikan titik didih molal air adalah 0,52. Larutan A dibuat dengan melarutkan 58,5 g NaCl (Mr = 58,5) ke dalam 5,0 kg air. Larutan B dibuat dengan melarutkan 190 g MgCl2 (Mr = 95) ke dalam 5,0 kg air. Kedua senyawa tersebut terionisasi sempurna dalam air. Perbandingan ΔTb larutan A terhadap ΔTb larutan B adalah….
- 6/5
- 2/3
- 1/2
- 2/5
- 1/3
PEMBAHASAN :
Diketahui:
Gr NaCl = 58,5 g
Mr NaCl = 58,5
P air yang dilarutkan NaCl = 5 kg
Gr MgCl2 = 190 g
Mr MgCl2 = 95
P air yang dilarutkan MgCl2 = 5 kg
terionisasi sempurna artinya elektrolit kuat, maka
jumlah ion NaCl (n) = 2
jumlah ion MgCl2 (n) = 3
Menetukan perbandingan kenaikan titik didih kedua larutan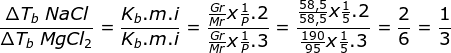
Jawaban E
Soal No.6 (SBMPTN 2014)
Gula 0,1 mol dan garam LX2 0,1 mol dengan derajat ionisasi 0,5 masing-masing dilarut dalam 1 liter air (ρ = 1 g/ml), jika penurunan titik beku larutan gula t oC, maka penurunan titik beku larutan garam LX2 adalah…
- 1,5t oC
- 2t oC
- 2,5t oC
- 3t oC
- 3,5t oC
PEMBAHASAN :
Diketahui:
mol gula = 0,1 mol
mol LX2 = 0,1 mol
V air = 1 liter, maka P = ρ. V = 1 kg/L. 1 L = 1 kg
ΔTf gula = t oC
Menentukan ΔTf LX2 melalui perbandingan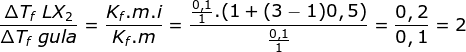
ΔTf LX2 = 2. ΔTf gula = 2t oC
Jawaban B
Soal No.7 (SBMPTN 2013)
Sebanyak 14,2 g Na2SO4 (Mr = 142) dilarutkan dalam 500 mL air (ρ = 1 g/mL) mempunyai titik didih 100,3 oC Bila 20 g zat organik nonelektrolit digunakan untuk menggantikan Na2SO4, titik didih larutannya menjadi 100,1 oC. Massa molekul relatif zat organik tersebut adalah….
Soal No.8 (SBMPTN 2012)
Sebanyak 620 g etilen glikol (Mr = 62) dilarutkan dalam 5 kg air (Kf = 1,86 oC/m). Titik beku larutan tersebut pada 1 atm adalah….
- 3,72 oC
- 1,86 oC
- -1,86 oC
- -3,72 oC
- -5,58 oC
PEMBAHASAN :
Diketahui:
Gr etilen glikol = 620 gram
Mr = 62
P = 5 kg
Kf = 1,86 oC/m
Menentukan titik beku larutan
ΔTf = Kf. m![]()
ΔTf = Tfo – TfL
3,72 = 0 – TfL
TfL = – 3,72 oC
Jawaban D
Soal No.9 (SNMPTN 2011)
Pernyataan yang benar untuk larutan Na2SO4 0,1 molal dalam air (Kf = 1,86 oC/molal) adalah….
- Mempunyai titik beku yang sama dengan larutan 9 gram urea (Mr = 60) dalam 500 g air
- Konsentrasi semua partikel terlarut adalah 0,6 molal
- Nilai faktor van’t Hoff untuk larutan tersebut adalah 3
- Larutan membeku pada -0,186 oC
PEMBAHASAN :
Menentukan titik beku Na2SO4 (elektrolit kuat dengan i = n = 3)
ΔTf = Kf. m. i
ΔTf = 1,86. 0,1. 3 = 0,558
ΔTf = Tfo – TfL
0,558 = 0 – TfL
TfL = – 0,558 oC
- Menentukan titik beku urea
ΔTf = Kf. m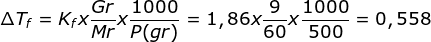
ΔTf = 1,86. 0,1. 3 = 0,558
ΔTf = Tfo – TfL
0,558 = 0 – TfL
TfL = – 0,558 oC
BENAR - Karena elektrolit kuat, maka jumlah partikel totalnya = 3, maka konsentrasi semua partikelnya = m. i = 0,1 x 3 = 0,3 m
SALAH - Nilai faktor Van’t Hoff (i) = jumlah ion (n) = 3
BENAR - Titik beku larutannya adalah -0,558 oC
SALAH
Maka jawaban yang benar adalah 1 dan 3
Jawaban B
Soal No.10 (SNMPTN 2009)
Diketahui Kf air = 1,86 Ar H = 1, C = 12 dan O = 16. Titik beku air dalam radiator mobil yang berisi cairan dengan perbandingan 62 g etilen glikol HOCH2CH2OH dalam 500 g air adalah….
- -0,93 oC
- -1,86 oC
- -3,72 oC
- -5,58 oC
- -7,64 oC
PEMBAHASAN :
Diketahui:
Gr etilen glikol = 62 gram
Mr = 62
P = 500 gram
Kf = 1,86 oC/m
Menentukan titik beku larutan
ΔTf = Kf. m![]()
ΔTf = Tfo – TfL
3,72 = 0 – TfL
TfL = – 3,72 oC
Jawaban C
Semoga Bermanfaat