Untuk Pembelajaran selanjutnya…
Soal No.1 (SBMPTN 2017)
Orbital hibrida yang digunakan oleh atom P (nomor atom = 15) untuk berikatan dalam molekul PF3 adalah….
PEMBAHASAN :
Atom F akan masuk 3 elektron memasuki orbital P yang ada 3 elektron tidak berpasangan. Maka akan membentuk hibridisasi sp3 dengan 1 PEB
Jawaban C
Soal No.2 (SBMPTN 2017)
Orbital hibrida yang digunakan oleh atom N (nomor atom = 7) untuk berikatan pada senyawa asetonitril H3C–C ≡ N adalah….
PEMBAHASAN :
Atom N hanya berikatan pada 1 atom yaitu atom C menggunakan orbital sp, sedangkan orbital s diisi oleh PEB, sehingga terdapat 2 elektron tereksitasi ke orbital p membentuk dua ikatan pi, dan satu ikatan sigma dari orbital sp dengan O. Kemudian membentuk satu ikatan rangkap tiga. Sehingga orbital yang digunakan untuk berikatan dengan O adalah hibrida sp
Jawaban B
Soal No.3 (SBMPTN 2017)
Dalam molekul di atas, orbital hibrida yang digunakan oleh atom C (nomor atom = 6) untuk berikatan dengan atom O adalah….
PEMBAHASAN :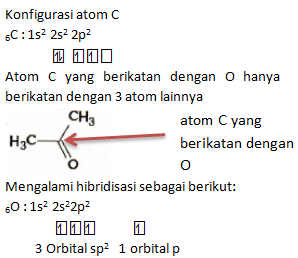
Atom C berikatan pada 3 atom yaitu 2 pada atom C dan 1 pada atom O. Ikatan pada O menggunakan orbital sp2, 1 elektron tereksitasi ke orbital p membentuk satu ikatan pi, dan satu ikatan sigma dari orbital sp2 dengan O. Kemudian membentuk satu ikatan rangkap dua. Sehingga orbital yang digunakan untuk berikatan dengan O adalah hibrida sp2
Jawaban A
Soal No.4 (SBMPTN 2016)
Senyawa kovalen X2Y tebentuk dariatom dengan nomor atom X dan Y berturut-turut 17 dan 8. Bentuk molekul yang sesuai untuk senyawa kovalen tersebut adalah….
- linear
- segitiga datar
- bentuk V
- piramida segitiga
- tetrahedral
PEMBAHASAN :
Senyawa X2Y yang bertindak sebagai atom pusat (jumlah lebih sedikit) yaitu Y
Menentukan konfigurasi atom pusat
8Y : 1s2 2s2 2p4, e.v = 6
Menentukan pasangan elektron bebas(E)![]()
Maka bentuk domain elektronnya
A = 1 (jumlah atom pusat)
X = 2 (PEI)
E = 2 (PEB)
AX2E2
bentuknya yaitu bentuk V
Jawaban C
Soal No.5 (UMPTN 2015)
Nomor atom fluor dan belerang berturut-turut adalah 9 dan 16. Pernyataan yang benar tentang senyawa belerang tetra fluorida adalah…
- Bersifat polar
- Mempunyai sudut ikatan F – S – F sebesar 109o
- Memiliki sepasang elektron bebas pada atom S
- Berbentuk tetrahedral
PEMBAHASAN :
Belerang tetra fluorida memiliki rumus SF4
- Menentukan polar tidaknya dapat dilihat dari ada tidaknya PEB
Atom pusat yaitu S dengan elektron valensi = 6 dan PEI = 4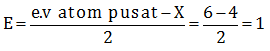
Memiliki PEB sehingga bersifat polar - Menentukan sudut harus mengetahui bentuk molekulnya terlebih dahulu, melalui teori domain elektron.
AX4E (A = atom pusat, X = PEI, E = PEB)
maka bentuk molekulnya adalah bidang 4 atau jungkat jungkit yang memiliki sudut 173o
- Memiliki 1 PEB dihitung pada no.1
- Memiliki bentuk bidang 4 atau jungkat jungkit.
Maka jawaban yang benar adalah 1 dan 3
Jawaban B
Soal No.6 (SBMPTN 2015)
Atom N dan Cl masing-masing memiliki nomor atom 7 dan 17. Molekul yang dibentuk oleh kedua atom tersebut ….
- memiliki ikatan kovalen polar
- mempunyai rumus NCl5
- berbentuk piramida segitiga
- tidak memiliki pasangan elektron bebas pada atom pusatnya
PEMBAHASAN :
Menentukan konfigurasi elektronnya
7N : 1s2 2s2 2p3 (menangkap 3e) |x1
17Cl : 1s2 2s2 2p6 3s2 3p5 (menangkap 1e) |x3
Senyawa yang terbentuk adalah NCl3
Menentukan sifat kepolaran
bisa ditentukan dari ada tidaknya PEB, menentukan PEB:![]()
Memiliki PEB sebanyak 1 pasang berarti ikatannya termasuk ikatan kovalen polar.
Menentukan bentuk molekulnya
A = 1 (jumlah atom pusat)
X = 3 (PEI)
E = 1 (PEB)
AX3E
bentuknya yaitu piramid segitiga
Jawaban yang benar 1,2 dan 3
Jawaban E
Soal No.7 (SIMAK UI 2013)
Interaksi yang dominan antara molekul pelarut dan zat terlarut yang terdapat pada larutan etilen glikol dalam air adalah ….
- gaya London
- ikatan hidrogen
- dipol terinduksi – dipol permanen
- ion – dipol permanen
- ion – ion
PEMBAHASAN :
Etilen glikol mengandung gugus fungsi alkohol yang dapat berinteraksi dengan air melalui ikatan hidrogen.
Jawaban B
Soal No.8 (SBMPTN 2014)
Diketahui atom X memiliki 16 proton. Menurut kaidah oktet, molekul-molekul yang dapat dibentuk dengan 8Y adalah….
- XY2 dan XY3
- XY dan XY2
- X2Y dan XY3
- hanya XY2
- hanya XY3
PEMBAHASAN :
Atom X memiliki 16 proton yang sama dengan jumlah elektronnya, jika dikonfigurasikan maka:
16X = 1s2 2s2 2p6 3s2 3p4 (menangkap 2e-) merupakan atom S
8Y = 1s2 2s2 2p4 (menangkap 2e-) merupakan atom O
Maka jika berikatan akan membentuk XY2 dan XY3 (SO2 dan SO3)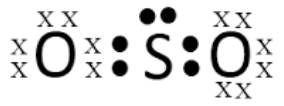
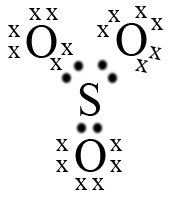
Jawaban A
Soal No.9 (SBMPTN 2014)
Atom-atom dengan notasi 6X, 9Y, 16Z, dan 17T dapat membentuk senyawa dengan rumus molekul ….
- XY2T2, XZ2, dan ZY6
- XTY2, XY, dan ZY
- XYT2, XZ4, dan ZY6
- TXY2, XY, dan XZ4
- YTX2, XY, dan ZY6
PEMBAHASAN :
Konfigurasi elektron masing-masing atom
6X : 1s2 2s2 2p2 (menangkap 4e)
9Y : 1s2 2s2 2p5 (menangkap 1e)
16Z : [Ne] 3s2 3p4(menangkap 2e)
17T : [Ne] 3s2 3p5 (menangkap 1e)
Pilihan yang tepat adalah pilihan A
XY2T2
atom X dapat menangkap 4e dari 2Y dan 2T yang masing-masing Y dan T menangkap 1 e dari X
Senyawa kedua atom X dapat menangkap 2e dari 2 atom Z yang masing-masing atom Z menangkap 2e dari atom X
Sedangkan ZY6 merupakan senyawa yang tidak mengikuti kaidah oktet karena termasuk senyawa oktet berkembang.
Jawaban A
Soal No.10 (SNMPTN 2012)
Atom S (Z = 16) dapat berikatan dengan O (Z = 8) membentuk SO3. Pernyataan yang benar untuk molekul SO3 adalah….
- berbentuk tetrahedral
- merupakan oksida asam
- mempunyai sepasang elektron bebas pada atom pusat
- bersifat non polar
PEMBAHASAN :
Jika dikonfigurasikan atom S dan O maka:
16S = 1s2 2s2 2p6 3s2 3p4 (menangkap 2e-)
8Y = 1s2 2s2 2p4 (menangkap 2e-)
Jika digambarkan struktur lewis SO3
- Bentuk molekul jika menggunakan teori domain elektron maka memiliki domain elektron AX3 (A = atom pusat, X = PEI) sedangkan PEB = 0, maka bentuknya segitiga datar
- Merupakan oksida asam yang jika direaksikan dengan air akan menghasilkan H2SO4 . Oksida asam berasal dari gabungan unsur non logam (S) dengan oksigen (O).
- Tidak memiliki PEB.
- Karena tidak ada PEB maka bersifat non polar
Jawaban yang benar adalah 2 dan 4
Jawaban D
Semoga Bermanfaat
