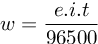Untuk Pembelajaran selanjutnya…
Tulislah reaksi elektrolisis berikut (elektrode grafit)
a. Larutan NaCl
b. Larutan H2SO4
c. Larutan Na2SO4
d. Larutan KI
e. Larutan MgCl2
f. Larutan Al2O3
PEMBAHASAN :
a. Elektolisis Larutan NaCl Elektrode C
Reaksi Ionisasi NaCl:
NaCl → Na+ + Cl–
(Ke Katoda) (Ke Anoda)
Reaksi Elektrolisisnya:
Katoda: 2H2O + 2e– → 2OH– + H2 (Karena larutan ada H2O)
Anoda : 2Cl– → Cl2 + 2e +
2H2O + 2Cl– → Cl2 + 2OH– + H2
b. Elektolisis Larutan H2SO4 Elektrode C
Reaksi Ionisasi H2SO4:
H2SO4 → 2H+ + SO42-
(Ke Katoda) (Ke Anoda)
Reaksi Elektrolisisnya:
Katoda: 2H+ + 2e– → H2 (x2)
Anoda : 2H2O → 4H+ + 4e + O2 (x1) +
2H2O → O2 + 2H2
c. Elektolisis Larutan Na2SO4 Elektrode C
Reaksi Ionisasi Na2SO4:
NaSO4 → 2Na+ + SO42-
(Ke Katoda) (Ke Anoda)
Reaksi Elektrolisisnya:
Katoda: 2H2O + 2e– → 2OH– + H2 (Karena larutan ada H2O) (x2)
Anoda : 2H2O → 4H+ + 4e + O2 (x1) +
6H2O → O2 + 2H2 + 4OH– + 4H+
d. Elektolisis Larutan KI Elektrode C
Reaksi Ionisasi KI:
KI → K+ + I–
(Ke Katoda) (Ke Anoda)
Reaksi Elektrolisisnya:
Katoda: 2H2O + 2e– → 2OH– + H2 (Karena larutan ada H2O)
Anoda : 2I– → I2 + 2e +
2H2O + 2I– → 2OH– + H2 + I2
e. Elektolisis Lelehan MgCl2 Elektrode C
Reaksi Ionisasi MgCl2:
MgCl2 → Mg2+ + 2Cl–
(Ke Katoda) (Ke Anoda)
Reaksi Elektrolisisnya:
Katoda: Mg2+ + 2e– → Mg
Anoda : 2Cl– → Cl2 + 2e +
Mg2+ + 2Cl– → Mg + Cl2
f. Elektolisis Lelehan Al2O3 Elektrode C
Reaksi Ionisasi Al2O3:
Al2O3 → 2Al3+ + 3O2-
(Ke Katoda) (Ke Anoda)
Reaksi Elektrolisisnya:
Katoda: 2Al3+ + 6e– → 2Al (x2)
Anoda : 6O2- → 3O2 + 12e +
4Al3+ + 6O2- → 4Al + 3O2
Soal No.2
Tulislah reaksi elektrolisis larutan CuSO4 dengan katode Fe dan anode Cu
PEMBAHASAN :
Elektolisis larutan CuSO4
Reaksi Ionisasi CuSO4:
CuSO4 → Cu2+ + SO42-
(Ke Katoda) (Ke Anoda)
Reaksi Elektrolisisnya:
Katoda: Cu2+ + 2e– → Cu ( Karena Cu lebih mudah mengalami reduksi dibanding Fe)
Anoda : Cu → Cu2+ + 2e + ( Karena Cu merupakan elektrode non inert) +
Cu → Cu
Soal No.3
Tulislah reaksi elektrolisis larutan AgNO3 dengan katode Fe dan anode Ag
PEMBAHASAN :
Elektolisis Lelehan AgNO3
Reaksi Ionisasi AgNO3:
AgNO3 → Ag+ + NO3–
(Ke Katoda) (Ke Anoda)
Reaksi Elektrolisisnya:
Katoda: Ag+ + e– → Ag ( Karena Ag lebih mudah mengalami reduksi dibanding Fe)
Anoda : Ag → Ag+ + e + ( Karena Ag merupakan elektrode non inert) +
Ag → Ag
LIHAT JUGA : Rangkuman Materi Elektrolisis & Faraday
Soal No.4
Tuliskan reaksi elektrolisis larutan berikut:
a. Larutan KI dengan elektrode Pt
b. Larutan Na2SO4 dengan elektrode alumunium
c. Larutan HCl dengan elektrode C
d. Larutan NiSO4 dengan elektrode C
e. Larutan NaOH dengan elektrode Pt
f. Larutan KNO3 dengan elektrode Pt
g. Larutan Zn(NO3)2 dengan elektrode Ag
h. Larutan CuSO4 dengan elektrode Cu
i. Leburan NaCl dengan elektrode C
j. Leburan Al2O3 dengan elektrode Pt
PEMBAHASAN :
a. Elektolisis Larutan KI Elektrode Pt
Reaksi Ionisasi KI Elektrode Pt:
KI → K+ + I–
(Ke Katoda) (Ke Anoda)
Reaksi Elektrolisisnya:
Katoda: 2H2O + 2e– → 2OH– + H2 (Karena larutan ada H2O)
Anoda : 2I– → I2 + 2e +
2H2O + 2I– → 2OH– + H2 + I2
b. Elektolisis Larutan Na2SO4 Elektrode Al
Reaksi Ionisasi Na2SO4:
Na2SO4 → 2Na+ + SO42-
(Ke Katoda) (Ke Anoda)
Reaksi Elektrolisisnya:
Katoda: 2H2O + 2e– → 2OH– + H2 (Karena larutan ada H2O) (x3)
Anoda : Al → Al3+ + 3e (Karena Al Elektrode non inert) (x2) +
6H2O + 2Al → 3H2 + 6OH– + 2Al3+
c. Elektolisis Larutan HCl Elektrode C
Reaksi Ionisasi HCl:
HCl → H+ + Cl–
(Ke Katoda) (Ke Anoda)
Reaksi Elektrolisisnya:
Katoda: 2H+ + 2e– → H2
Anoda : 2Cl– → Cl2 + 2e +
2H+ + 2Cl– → Cl2 + H2
d. Elektolisis Larutan NiSO4 Elektrode C
Reaksi Ionisasi NiSO4:
NiSO4 → Ni2+ + SO42-
(Ke Katoda) (Ke Anoda)
Reaksi Elektrolisisnya:
Katoda: Ni2+ + 2e– → Ni (x2)
Anoda : 2H2O → 4H+ + 4e + O2 (x1) +
2Ni2+ + 2H2O → 2Ni + 4H+ + O2
e. Elektolisis Larutan NaOH Elektrode Pt
Reaksi Ionisasi NaOH:
NaOH → Na+ + OH–
(Ke Katoda) (Ke Anoda)
Reaksi Elektrolisisnya:
Katoda: 2H2O + 2e– → 2OH– + H2 (Karena larutan ada H2O)
Anoda : 2Cl– → Cl2 + 2e +
Mg2+ + 2Cl– → Mg + Cl2
f. Elektolisis Larutan KNO3 Elektrode Pt
Reaksi Ionisasi KNO3:
KNO3 → K+ + NO3–
(Ke Katoda) (Ke Anoda)
Reaksi Elektrolisisnya:
Katoda: 2H2O + 2e– → 2OH– + H2 (Karena larutan ada H2O) (x2)
Anoda : 2H2O → 4H+ + 4e + O2 (x1) +
6H2O → O2 + 2H2 + 2OH– + 2H+
g. Elektolisis Larutan Zn(NO3)2 Elektrode Ag
Reaksi Ionisasi Zn(NO3)2:
Zn(NO3)2 → Zn2+ + 2NO3–
(Ke Katoda) (Ke Anoda)
Reaksi Elektrolisisnya:
Katoda: Zn2+ + 2e– → Zn (x1)
Anoda : Ag → Ag+ + e (Karena Ag Elektrode non inert) (x2) +
Zn2+ + 2Ag → Zn + 2Ag+
h. Elektolisis larutan CuSO4 Elektrode Cu
Reaksi Ionisasi CuSO4:
CuSO4 → Cu2+ + SO42-
(Ke Katoda) (Ke Anoda)
Reaksi Elektrolisisnya:
Katoda: Cu2+ + 2e– → Cu
Anoda : Cu → Cu2+ + 2e + ( Karena Cu merupakan elektrode non inert) +
Cu → Cu
i. Elektolisis Leburan NaCl Elektrode C
Reaksi Ionisasi NaCl:
NaCl → Na+ + Cl–
(Ke Katoda) (Ke Anoda)
Reaksi Elektrolisisnya:
Katoda: Na+ + e– → Na (x2)
Anoda : 2Cl– → Cl2 + 2e (x1) +
2Na+ + 2Cl– → 2Na + Cl2
j. Elektolisis Leburan Al2O3 Elektrode Pt
Reaksi Ionisasi Al2O3:
Al2O3 → 2Al3+ + 3O2-
(Ke Katoda) (Ke Anoda)
Reaksi Elektrolisisnya:
Katoda: 2Al3+ + 6e– → 2Al (x2)
Anoda : 6O2- → 3O2 + 12e +
4Al3+ + 6O2- → 4Al + 3O2
Soal No.5
Hitunglah massa perak yang dapat dibebaskan oleh arus 10 ampere yang dialirkan selama 5 menit ke dalam larutan AgNO3 (Ar Ag =108)
PEMBAHASAN :
Soal ini diselesaikan dengan hukum Faraday I, dengan rumusan:![]()
diketahui : i = 10 A, t = 5 menit = 300 s![]()
![]()
LIHAT JUGA : Contoh Soal Elektrolisis Bagian II
Soal No.6
Alumunium diperoleh dari elektrolisis lelehan Al2O3. Berapa alumunium dapat diperoleh setiap jam jika digunakan arus 100 ampere
PEMBAHASAN :
Soal ini diselesaikan dengan hukum Faraday I, dengan rumusan:![]()
diketahui : i = 100 A, t = 1 jam = 3600 s![]()
![]()
Soal No.7
Sejumlah arus dapat mengendapkan 1,08 gram perak dari larutan perak nitrat (AgNO3). Jika arus yang sama dialirkan ke dalam nikel sulfat (NiSO4), berapa gram nikel dapat diendapkan? (Ar Ni = 59; Ag = 108)
PEMBAHASAN :
Soal ini diselesaikan dengan hukum Faraday II karena dua sel elektrolisis menggunakan arus yang sama, dengan rumusan:![]()
diketahui : wAg = 1,08 gram![]()
![]()
![]()
![]()
![]()
Soal No.8
Pada elektrolisis larutan CuSO4 dihasilkan 25,4 gram endapan Cu pada katode. Hitunglah volume gas H2 (0 oC, 1 atm) yang dibebaskan pada elektrolisis larutan H2SO4 encer dengan jumlah arus yang sama (Ar Cu = 63,5; O = 16)
PEMBAHASAN :
menentukan jumlah mol elektron dari elektrolisis CuSO4
Reaksi Elektrolisis CuSO4:
CuSO4 → Cu2+ + SO42-
Katoda : Cu2+ + 2e → Cu (x2)
Anoda : 2H2O → 4H+ + 4e + O2
Karena reaksi di katoda dikali 2, maka:
Katoda : 2Cu2+ + 4e → 2Cu
Anoda : 2H2O → 4H+ + 4e + O2
menghitung mol Cu![]()
maka berdasarkan perbandingan koefisien, mol elektron:![]()
Menentukan mol H2 dari elektrolisis H2SO4 dengan arus yang sama/mol e sama
Reaksi Elektrolisis H2SO4:
H2SO4 → 2H+ + SO42-
Katoda : 2H+ + 2e → H2 (x2)
Anoda : 2H2O → 4H+ + 4e + O2
Karena reaksi di katoda dikali 2, maka:
Katoda : 4H+ + 4e → 2H2
Anoda : 2H2O → 4H+ + 4e + O2
maka berdasarkan perbandingan koefisien dengan mol e, mol H2:![]()
Volume H2 pada keadaan STP (0 oC, 1 atm):![]()
Soal No.9
Arus sebesar i ampere dapat mengendapkan 2,16 gram perak dari larutan perak nitrat dalam 1 jam. Berapa liter gas oksigen dapat dihasilkan jika arus yang sama dialirkan ke dalam larutan asam sulfat selama 2 jam? (Ar Ag = 108)
PEMBAHASAN :
menentukan jumlah mol elektron dari elektrolisis AgNO3
Reaksi Elektrolisis AgNO3:
AgNO3 → Ag+ + NO3–
Katoda : Ag+ + e → Ag (x4)
Anoda : 2H2O → 4H+ + 4e + O2
Karena reaksi di katoda dikali 4, maka:
Katoda : 4Ag+ + 4e → 4Ag
Anoda : 2H2O → 4H+ + 4e + O2
menghitung mol Ag![]()
menghitung mol e melalui perbandingan koefisien dengan mol Ag:![]()
menentukan jumlah arus (i) yang digunakan![]()
![]()
Menentukan mol elektron dari elektrolisis H2SO4![]()
![]()
Menentukan volume oksigen
Reaksi Elektrolisis H2SO4:
H2SO4 → 2H+ + SO42-
Katoda : 2H+ + 2e → H2 (x2)
Anoda : 2H2O → 4H+ + 4e + O2
Karena reaksi di katoda dikali 2, maka:
Katoda : 4H+ + 4e → 2H2
Anoda : 2H2O → 4H+ + 4e + O2
maka berdasarkan perbandingan koefisien dengan mol e, mol O2:![]()
Volume O2 jika dianggap pada keadaan STP (0 oC, 1 atm):![]()
Soal No.10
Hitunglah massa klorin dan NaOH yang terbentuk dari elektrolisis larutan NaCl jika digunakan arus 10.000 ampere selama 12 jam. (Ar H = 1; O = 16; Na = 23; Cl = 35,5)
PEMBAHASAN :
menentukan jumlah mol elektron (t = 12 jam = 43200 s)![]()
Menentukan mol NaOH dan Cl2 dari elektrolisis larutan NaCl
Reaksi Elektrolisis NaCl:
NaCl → Na+ + Cl–
Katoda : 2H2O + 2e → 2OH– + H2
Anoda : 2Cl– → Cl2 + 2e
menghitung mol NaOH dari OH– diperoleh dari perbandingan dengan mol e. Karena koefisien elektron dengan OH– sama, maka molnya pun sama. mol NaOH = 4476,68 mol
Menghitung mol Cl2 melalui perbandingan dengan koefisien elektron. Karena koefisien Cl2 1/2 dari koefisien elektron maka mol Cl2 = 1/2 x 4476,68 = 2238,34 mol
menghitung massa NaOH
Gr = n x Mr = 4476,68 mol x 40 = 179067,2 gram
menghitung massa Cl2
Gr = n x Mr = 2238,34 mol x 71 = 158922,14 gram
Sumber Soal : Kimia Kelas XII Pengarang Michael Purba Penerbit Erlangga
Semoga Bermanfaat