Untuk Pembelajaran selanjutnya…
Soal No.21
Gas HI sebanyak 2 mol dalam wadah 5 L terurai sesuai persamaan reaksi :
2HI (g) ⇌ H2(g) + I2(g)
Jika pada saat setimbang terdapat perbandingan mol HI : I2 = 2 : 1, tetapan kesetimbangan dari reaksi tersebut adalah?
PEMBAHASAN :
Diketahui Reaksi: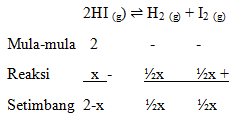
Diketahui perbandingan mol HI dan I2 adalah 2 : 1, maka: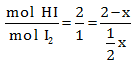
Dengan dikali silang, maka:
2. ½x = 1. (2 – x)
x = 2 – x
2x = 2
x = 1
Sehingga mol masing-masing zat saat setimbang adalah
mol HI = 2 – x = 2 – 1 = 1
mol H2 = mol I2 = ½ x = ½ . 1 = ½
Nilai Kc adalah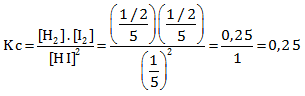
Jawaban B
Soal No.22
Perhatikan reaksi kesetimbangan berikut.
2NO (g) + O2(g) ⇌ 2NO2(g) Kc = K1
4NO2(g) ⇌ 4NO (g) + 2O2(g) Kc = K2
Nilai K2 dalam reaksi tersebut dapat dinyatakan sebagai?
PEMBAHASAN :
Diketahui
2NO (g) + O2(g) ⇌ 2NO2(g) Kc = K1
2NO2(g) ⇌ 4NO (g) + 2O2(g) Kc = K2
Perubahan dari reaksi kesatu agar menjadi reaksi kedua adalah
Soal No.23
Tetapan kesetimbangan untuk reaksi kesetimbangan :
2A (g) + B (g) ⇌ C (g) + D (g)
Pada suhu tertentu adalah 8. Jika pada suhu tetap volume diubah menjadi sepertiga volume asal, tetapan kesetimbangannya adalah?
PEMBAHASAN :
Pada kesetimbangan saat suhu tetap maka nilai K tidak akan berubah walaupun volume diubah. Maka jawabannya nilai K saat volume diubah menjadi sepertiganya adalah tetap = 8
Jawaban C
Soal No.24
Sebanyak 1 mol PCl5 dalam suatu ruangan terurai sebanyak 25% membentuk PCl3 dan Cl2. Jika tekanan total campuran gas adalah 5 atm, nilai Kp reaksi adalah?
Soal No.25
Perhatikan reaksi kesetimbangan berikut :
PCl5(g) ⇌ PCl3(g) + Cl2(g)
Pada suhu 27°C, nilai Kc = 0,04. Nilai Kp pada kesetimbangan tersebut adalah?
- 0,0885
- 0,0984
- 0,885
- 0,984
- 1,080
PEMBAHASAN :
Menentukan Kp jika diketahui Kc maka dapat menggunakan rumus
Kp = Kc (RT)Δn
T = 27 oC + 273 = 300 K
Δn = Σkoefisien produk – Σkoefisien pereaksi = 2 – 1
Kp = 0,04 (0,082. 300)1
Kp = 0,04. 24,6 = 0,984
Jawaban D
Soal No.26
Perhatikan reaksi kesetimbangan berikut.
2CO (g) + O2(g) ⇌ 2CO2(g)
Pada suhu tertentu, 4 mol CO direaksikan dengan O2 dan ternyata dalam kesetimbangan terdapat 2 mol CO. jika volume ruangan 10 liter dan nilai tetapan kesetimbangan sama dengan 4, banyaknya O2 yang diperlukan adalah?
- 0,40 mol
- 0,25 mol
- 2,5 mol
- 3,5 mol
- 4 mol
Soal No.27
Gas Amonia diproduksi melalui reaksi kesetimbangan :
N2(g) + 3H2(g) ⇌ 2NH3(g) ∆H = -92 kJ
Pada proses tersebut ditambahkan katalis Pt-Rh dengan tujuan agar?
- Reaksi bergeser ke kanan sehingga dihasilkan gas NH3 lebih banyak
- Pt-Rh berperan untuk mempercepat terjadinya reaksi kesetimbangan
- Laju reaksi ke kanan berlangsung lebih cepat daripada ke kiri
- Pt-Rh akan menyerap NH3 yang dihasilkan sehingga terpisah dari sistem
- Katalis akan menurunkan nilai perubahan entalpi pembentukan
PEMBAHASAN :
Pt-Rh merupakan katalis yang tidak berperan dalam pergeseran kesetimbangan. Tapi katalis dalam reaksi kesetimbangan berperan dalam mempercepat terjadinya reaksi kesetimbangan
Jawaban B
Soal No.28
Pada suhu dan tekanan tertentu di dalam bejana yang volumenya 200 cm3 terdapat kesetimbangan :
2SO2(g) + O2(g) ⇌ 2SO3(g) ∆H = -198,2 kJ
Pada suhu tetap volume sistem dijadikan 1.000 cm3. Setelah sistem kembali pada keadaan setimbang maka?
- Konsentrasi gas oksigen akan menjadi setengah dari konsentrasi semula
- Konsentrasi gas SO3 sama dengan konsentrasi semula
- Konsentrasi gas SO3 menjadi lebih kecil dari konsentrasi semula
- Tekanan sistem menjadi lima kali dari tekanan sistem semula
- Perubahan yang terjadi tidak dapat diramalkan
PEMBAHASAN :
Jika volume sistem diperbesar maka reaksi akan bergeser ke koefisien yang besar. Yaitu ke sebelah kiri atau jumlah zat yang sebelah kiri(SO2 dan O2) akan bertambah dan yang sebelah kanan (SO3) akan berkurang. Sehingga jawaban yang tepat adalah C
Jawaban C
Soal No.29
Perubahan tekanan tidak menyebabkan pergeseran sistem kesetimbangan pada reaksi?
- 2SO3(g) ⇌ 2SO2 (g) + O2 (g)
- N2 (g) + O2 (g) ⇌ 2NO (g)
- N2 (g) + 3H2 (g) ⇌ 2NH3 (g)
- PCl5 (g) ⇌ PCl3 (g) + Cl2 (g)
- 2H2 (g) + O2 ⇌ 2H2O (g)
PEMBAHASAN :
Perubahan tekanan tidak akan terpengaruh ketika koefisien zat yang berwujud gas sama di sebelah kiri dengan sebelah kanan. Seperti yang ditunjukan pilihan B
N2 (g) + O2 (g) ⇌ 2NO (g)
Koefisien zat sebelah kiri adalh 2 dan sebelah kanan juga 2. Maka pengaruh tekanan tidak akan berpengaruh
Jawaban B
Soal No.30
Dari reaksi kesetimbangan :
Fe3-(aq) + SCN+(aq) ⇌ FeSCN2-(aq)
Jika ditambah 1 tetes larutan jenuh FeCl3 maka?
- Jumlah ion SCN+ akan bertambah
- Jumlah ion Fe3- akan berkurang
- Jumlah ion FeSCN2- akan bertambah
- Jumlah ion FeSCN2- akan berkurang
- Jumlah ketiga ion tetap
PEMBAHASAN :
Menambahkan larutan FeCl3 berarti menambahkan ion Fe3+. Menurut asas Le Chatelier, jika konsentrasi salah satu zat ditambah maka akan bergeser menjauhi zat yang ditambah tersebut. Jika Fe3+ ditambah maka akan bergeser menjauhi Fe3+ atau bergeser ke kanan yang artinya jumlah ion FeSCN2- akan bertambah
Jawaban C
Semoga Bermanfaat