pembahasan selanjutnya adalah
- ikatan kimia,
- unsur periode ketiga,
- sifat ikatan kimia,
- bilangan kuantum, serta
- tata nama dan persamaan reaksi.
Soal No. 1 tentang Ikatan Kimia
M : [Ar] 4s2
N : [Ne] 3s2 3p5
Apabila M dan N berikatan, rumus senyawa yang terbentuk adalah ….
A. MN
B. MN2
C. MN3
D. M2N
E. M3N
Pembahasan
Pada prinsipnya, semua atom ingin mulia. Maksudnya ingin mempunyai elektron terluar seperti gas mulia, yaitu 8. Dalam istilah kimia, ketentuan ini disebut kaidah oktet.
Atom M dengan konfigurasi elektron [Ar] 4s2, berarti mempunyai 2 elektron valensi (elektron terluar). Agar elektron valensinya bisa 8, atom M harus menangkap elektron sebanyak 6. Hal ini sangat berat bagi M. Jalan satu-satunya, atom M harus rela melepas 2 elektron terluarnya tersebut sehingga berubah wujud menjadi ion M2+.
Sedangkan atom N dengan konfigurasi elektron [Ne] 3s2 3p5, berarti memiliki elektron valensi sebanyak 7 (2 + 5). Jika atom N ikut-ikutan melepas elektron seperti atom M maka ia harus melepas 7 elektron valensinya.
“Ini tidak mungkin. Ini pemborosan,’ pikir atom N. Akhirnya atom N memutuskan untuk menangkap 1 elektron agar tercapai target 8. Jadilah atom N dalam bentuk ion N–.
Bayangkan ion M2+ adalah orang yang mengulurkan 2 tangannya. Sedangkan ion N– adalah orang yang mengulurkan 1 tangannya. Jika semua tangan harus bergandengan maka seorang M2+ akan membutuhkan 2 orang N–.
−M− + −N → N−M−N
M2+ + N– → MN2
Jadi, rumus senyawa yang terbentuk antara M dan N adalah MN2 (B).
Soal No. 2 tentang Unsur Periode Ketiga
| Unsur | Nomor Atom |
| P Q R S |
11 12 13 14 |
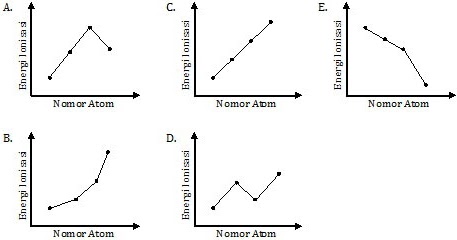
Grafik yang tepat menggambarkan perubahan energi ionisasi unsur-unsur tersebut adalah ….


Pembahasan
Unsur-unsur yang disebutkan dalam soal sebenarnya adalah sebagian dari unsur-unsur periode ketiga. Perhatikan tabel berikut ini.
| Unsur | 11Na | 12Mg | 13Al | 14Si |
| Elektron Valensi | 3s1 | 3s2 | 3s2 3p1 | 3s2 3p2 |
Secara teoretis, energi ionisasi (EI) makin ke kanan makin besar. Tapi teori ini tidak berlaku pada unsur-unsur periode ketiga karena terdapat penyimpangan pada Aluminium (Al) dan Sulfur (S).
Seharusnya EI Al > EI Mg
Kenyataannya EI Al < EI Mg
Hal ini disebabkan kestabilan jumlah elektron valensi pada sub kulitnya. Dikatakan stabil apabila subkulit terisi penuh atau setengah penuh.
12Mg : [Ne] 3s2
(kulit s terisi penuh → stabil)
13Al : [Ne] 3s2 3p1
(kulit p tidak terisi penuh → tidak stabil)
Dengan demikian grafiknya adalah berikut ini.

Jadi, grafik yang tepat menggambarkan perubahan energi ionisasi unsur-unsur tersebut adalah grafik pada opsi (D).
Soal No. 3 tentang Sifat Ikatan Kimia
| Zat | Titik Leleh | Kelarutan dalam air | Padatan | Lelehan | Larutan |
| X Y |
−115 −94 |
Larut Tidak larut |
− − |
− − |
+ − |
Keterangan:
(−) : nonkonduktor
(+) : isolator
Berdasarkan data tersebut, dapat disimpulkan bahwa ….
| Zat X | Zat Y | |
| A | Senyawa kovalen polar | Senyawa kovalen nonpolar |
| B | Senyawa kovalen polar | Senyawa kovalen polar |
| C | Senyawa kovalen nonpolar | Senyawa kovalen nonpolar |
| D | Senyawa ionik | Senyawa kovalen polar |
| E | Senyawa kovalen polar | Senyawa ionik |
Pembahasan
Untuk menjawab soal di atas, kita harus mengetahui perbedaan antara sifat ikatan ion, kovalen polar, dan kovalen nonpolar. Perhatikan tabel berikut ini!
| Ikatan Ion | Kovalen Polar | Kovalen Nonpolar | |
| Wujud pada suhu kamar | padat | padat, cair, gas | padat, cair, gas |
| Struktur kristal | keras, rapuh | lunak, tidak rapuh | lunak, tidak rapuh |
| Titik didih dan titik leleh | tinggi | rendah | rendah |
| Kelarutan dalam air | larut | larut | tidak larut |
| Fase daya hantar listrik | lelehan, larutan | larutan | tidak menghantarkan |
Berdasarkan tabel di atas, sifat zat X dan zat Y berturut-turut adalah senyawa kovalen polar dan nonpolar (A).
Perdalam materi ini di Pembahasan Kimia UN: Sifat Ikatan Kimia.
Soal No. 4 tentang Bilangan Kuantum
A. n = 3; l = 0; m = −1; s = +½
B. n = 3; l = 0; m = +1; s = −½
C. n = 3; l = 1; m = +1; s = +½
D. n = 3; l = 2; m = 0; s = −½
E. n = 3; l = 1; m = 0; s = −½
Pembahasan
Untuk menentukan bilangan kuantum, langkah pertama adalah menentukan konfigurasi elektronnya.
17Cl : ]Ne] 3s2 3p5
Elektron terakhir terletak pada 3p5, artinya elektron terakhir terletak pada kulit ke-3 (n = 3) dan subkulit p (l = 1). Ingat s, p, d, f (sepeda federal, s = 0, p = 1, d = 2, f = 3).
Untuk menentukan bilangan kuantum m dan s, kita gambarkan orbital atau kamar elektron pada subkulit p. Ada 5 elektron yang menempati subkulit p.
Secara berurutan, kelima elektron tersebut menempati 3 kamar yang tersedia sebagai berikut: elektron pertama menempati kamar nomor −1, elektron kedua menempati kamar nomor 0, dan elektron ketiga menempati kamar nomor +1.
Karena semua kamar sudah terisi satu elektron, maka elektron keempat menempati kamar nomor −1 bersama dengan elektron pertama. Sedangkan elektron terakhir menempati kamar bersama dengan elektron kedua.
Dengan demikian, elektron terakhir menempati kamar nomor 0 (m = 0). Sebagai elektron kedua yang menempati kamar tersebut, posisinya digambarkan terbalik (s = −½).
Jadi, keempat bilangan kuantum elektron terakhir dari atom 17Cl adalah n = 3; l = 1; m = 0; s = −½ (E).
Soal No. 5 tentang Tata Nama dan Persamaan Reaksi
A. C2H12(l) + 😯2(g) → 5CO2(g) + 6H2O(g)
B. C6H14(l) + 19/2O2(g) → 6CO2(g) + 7H2O(g)
C. C7H16(l) + 11O2(g) → 7CO2(g) + 8H2O(g)
D. 2 C8H18(l) + 25O2(g) → 16CO2(g) + 18H2O(g)
E. C9H20(l) + 14O2 (g) → 9CO2(g) + 10H2O(g)
Pembahasan
Kalau diperhatikan pilihan jawabannya, kita hanya diminta menentukan rumus dari heptana. Secara harfiah, heptana adalah golongan alkana yang mempunyai jumlah atom C sebanyak 7. Dari semua opsi jawaban, yang mempunyai jumlah atom C sebanyak 7 hanya opsi C.
Supaya pembahasannya agak panjang, akan Kak Ajaz ulas lebih dalam (lagi nggak ada kerjaan). Alkana dirumuskan sebagai berikut:
CnH2n+2
n = 7 → C7H16
Kemudian heptana ini dibakar sempurna atau direaksikan dengan oksigen. Pembakaran sempurna pada hidrokarbon selalu menghasilkan karbondioksida dan air. Reaksinya sebagai berikut.
C7H16 + O2 → CO2 + H2O
Jika tidak diperlukan, fase reaksi seperti (g), (aq), atau (s) tidak perlu ditulis. Pembuat soal sengaja menulisnya supaya soal terkesan sulit. Ok, lanjut!
Reaksi di atas tinggal disetarakan. Patokannya pada C7H16. Karena jumlah C-nya 7 maka CO2 harus dikalikan 7. Jumlah H pada heptana ada 16 sehingga H2O harus dikalikan 8. Sekarang tinggal dihitung jumlah O pada CO2 dan H2O setelah dikalikan. Ternyata jumlah O ada 22, maka O2 harus dikalikan 11. Hasil akhirnya sebagai berikut:
C7H16 + 11O2 → 7CO2 + 8H2O
Jadi, persamaan reaksi yang tepat adalah opsi (C).
Simak Pembahasan Soal Kimia UN 2015 selengkapnya.
Dapatkan pembahasan soal dalam file pdf di sini.
Terimakasih
Semoga Bermanfaat