pembahasan selanjutnya adalah
Pembahasan soal-soal Ujian Nasional SMA IPA bidang studi Kimia dengan materi pembahasan Jenis Ikatan Kimia.
Soal tentang Jenis Ikatan Kimia UN 2015
X : [Ar] 4s2 3d6
Z : [Ne] 3s2 3p5
Apabila X dan Z bersenyawa, rumus senyawa yang terbentuk adalah ….
A. X3Z
B. X3Z2
C. X2Z
D. X2Z3
E. XZ3
Pembahasan
Perhatikan konfigurasi elektron unsur X.
X : [Ar] 4s2 3d6
Elektron valensinya adalah 8 (2 + 6). Elektron valensi seperti ini cenderung melepas 2 elektron dari subkulit s sehingga membentuk ion X2+, atau melepas 3 elektron (2 dari subkulit s dan 1 dari subkulit d) sehingga membentuk ion X3+. Keadaan yang terakhir ini lebih stabil karena subkulit d terisi setengah penuh.
X2+ : [Ar] 4s 3d6
X3+ : [Ar] 4s 3d5 (lebih stabil)
Sementara itu unsur Z mempunyai elektron valensi 7 (2 + 5). Dengan valensi 7 ini, unsur Z cenderung menangkap 1 elektron agar tercapai valensi gas mulai (8) sehingga membentuk ion Z−.
Ikatan yang terbentuk antara unsur X dan Z adalah
X3+ + Z− → XZ3
Jadi, rumus senyawa yang terbentuk antara X dan Z adalah XZ3 (E).
Soal tentang Jenis Ikatan Kimia UN 2010
A. XZ dan ion
B. X2Z dan ion
C. XZ2 dan ion
D. X2Z dan kovalen
Z. XZ2 dan kovalen

Pembahasan
Soal seperti ini lebih enak dikerjakan dengan cara mengurangi nomor atom unsur-unsur tersebut dengan nomor atom unsur-unsur gas mulia terdekat. Hafalkan dulu nomor atom gas mulia berikut ini.
2, 10, 18, 36, 54
Diperoleh:
11X : 11 − 10 = +1 → X+1 (melepas 1 elektron)
16Z : 16 − 18 = −2 → Z−2 (menangkap 2 elektron)
Dengan demikian, ikatan antara unsur X dan Z adalah
X+1 + Z−2 → X2Z
Karena ikatan tersebut terjadi antara ion positif dan ion negatif maka jenis ikatannya adalah ikatan ion.
Jadi, ikatan antara X dan Z adalah ikatan ion dengan rumus senyawa X2Z (B).
Soal tentang Jenis Ikatan Kimia UN 2009
A. G2Cl, ionik
B. GCl, kovalen
C. GCl3, kovalen
D. G2Cl3, ionik
E. GCl2, kovalen
Pembahasan
Kita selesaikan dengan mengurangkan nomor atomnya dengan nomor atom gas mulia.
15G : 15 − 18 = −3 → menangkap 3 elektron
17Cl : 17 − 18 = −1 → menangkap 1 elektron
Karena sama-sama menangkap elektron maka terjadi pemakaian elektron secara bersama-sama sehingga ikatan yang terbentuk adalah ikatan kovalen dengan rumus senyawa GCl3.
Jadi, senyawa yang dibentuk oleh G dan Cl adalah GCl3 dengan jenis ikatan kovalen (C).
Soal tentang Jenis Ikatan Kimia UN 2013
Perhatikan gambar struktur Lewis senyawa H2SO4 berikut ini!
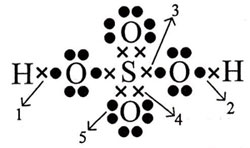
Ikatan kovalen koordinasi ditunjukkan oleh nomor … (nomor atom H = 1; S = 16; O = 8)
A. 1
B. 2
C. 3
D. 4
E. 5
Pembahasan
Ikatan kovalen koordinasi adalah pemakaian elektron bersama yang hanya berasal dari salah satu atom. Pada struktur Lewis H2SO4 di atas, terlihat bahwa ikatan nomor 4 hanya berasal dari atom S tetapi digunakan bersama dengan atom O.
Jadi, ikatan kovalen koordinasi ditunjukkan oleh nomor 4 (D).
Soal tentang Jenis Ikatan Kimia UN 2014
Perhatikan gambar ilustrasi tentang gaya intra dan antar-molekul berikut ini!
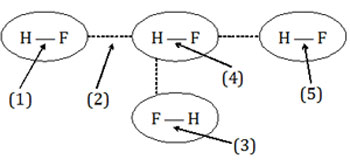
Ikatan hidrogen ditunjukkan oleh nomor ….
A. (1)
B. (2)
C. (3)
D. (4)
E. (5)
Pembahasan
Ikatan hidrogen adalah ikatan antarmolekul dari senyawa-senyawa yang sangat polar. Dari pengertian ini sudah terlihat bahwa hanya nomor 2 yang menunjukkan ikatan antarmolekul. Sedangkan yang lain menunjukkan ikatan intra-molekul atau ikatan antar-atom.
Jadi, yang menunjukkan ikatan hidrogen adalah nomor 2 (B).
Pembahasan soal Jenis Ikatan Kimia yang lain bisa disimak di:
Pembahasan Kimia UN 2014 No. 4
Pembahasan Kimia UN 2015 No. 1
Pembahasan Kimia UN 2016 No. 3
Pembahasan Kimia UN 2016 No. 18
Pembahasan Kimia UN 2017 No. 5
Pembahasan Kimia UN 2017 No. 7
Pembahasan Kimia UN 2018 No. 4
Pembahasan Kimia UN 2019 No. 12
Simak juga Pembahasan Soal UN tentang Sifat Ikatan Kimia.
Dapatkan pembahasan soal dalam file pdf di sini.
Terimakasih
Semoga Bermanfaat