pembahasan selanjutnya adalah
Pembahasan soal-soal Ujian Nasional SMA-IPA bidang studi Kimia dengan materi pembahasan Bentuk Molekul.
Soal tentang Bentuk Molekul UN 2013
N = 1s2 2s2 2p3
Cl = 1s2 2s2 2p6 3s2 3p5
Bentuk molekul dari senyawa yang terjadi jika kedua unsur tersebut berikatan sesuai aturan oktet adalah ….
A. linear
B. segitiga piramida
C. tetrahedral
D. segitiga bipiramida
E. oktahedral
Pembahasan
Teori yang paling mudah untuk memahami bentuk molekul suatu senyawa adalah teori domain elektron. Secara sederhana, tipe molekul dirumuskan
AXmEn
dengan
A : atom pusat
Xn : domain elektron ikatan (jumlah unsur lain yang terikat pada atom pusat)
Em : domain elektron bebas (jumlah pasangan elektron bebas pada atom pusat)
Namun, dalam teori ini kita diwajibkan menghafal bentuk-bentuk molekul berdasarkan tipe molekulnya. Berikut ini adalah tipe dan bentuk molekul yang harus dihafal.
| Tipe Molekul | Bentuk Molekul | Tipe Molekul | Bentuk Molekul |
| AX2 | linear, garis lurus |
AX4E | tetrahedral terdistorsi |
| AX3 | segitiga datar, trigonal planar |
AX3E2 | membentuk huruf T |
| AX2E | bentuk huruf V | AX2E3 | linear |
| AX4 | tetrahedral, tetrahedron, bidang empat |
AX6 | oktahedral oktahedron segi empat bipiramida |
| AX3E | segitiga piramida, trigonal piramida |
AX5E | segi empat piramida tetragonal piramida |
| AX2E2 | bentuk huruf V | AX4E2 | segi empat datar tetragonal planar |
| AX5 | segitiga bipiramida, trigonal bipiramida |
Nah, sekarang mari kita terapkan teori tersebut untuk menjawab soal di atas. Kita tentukan dulu elektron valensi (elektron terluar) masing-masing unsur.
N = 1s22s22p3 (5 elektron valensi)
Cl = 1s2 2s2 2p63s23p5 (7 elektron valensi)
Unsur N yang bervalensi 5 membutuhkan 3 elektron dari unsur Cl agar terpenuhi kaidah oktet (kaidah 8). Sedangkan unsur Cl yang bervalensi 7 hanya membutuhkan 1 elektron dari atom N. Berarti harus ada 3 unsur Cl yang berikatan dengan N sehingga terbentuk NCl3.
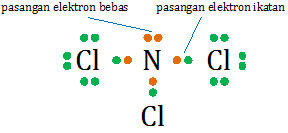
Unsur N sebagai atom pusat mempunyai 5 elektron terluar, 3 di antaranya berikatan dengan Cl dan 2 elektron bebas (sepasang elektron bebas).
- atom pusat : N
- PEI : 3
- PEB : ½(5 − 3) = 1
- tipe molekul : AX3E
- bentuk molekul : segitiga piramida
PEI : pasangan elektron ikatan
PEB : pasangan elektron bebas
Jadi, bentuk molekul dari senyawa yang terjadi jika unsur N dan Cl berikatan adalah segitiga piramida (B).
Soal tentang Bentuk Molekul UN 2013
Si = [Ne] 3s2 3p2
F = [He] 2s2 2p5
Jika kedua unsur tersebut membentuk senyawa, bentuk molekul yang terjadi sesuai aturan oktet adalah ….
A. linear
B. segitiga datar
C. tetrahedral
D. segitiga piramida
E. oktahedral

Pembahasan
Elektron valensi Si dan F adalah
Si = [Ne] 3s2 3p2 (4 elektron valensi)
F = [He] 2s2 2p5 (7 elektron valensi)
Unsur Si mempunyai 4 elektron terluar. Agar tercapai kaidah oktet, keempatnya harus berikatan dengan F sehingga tidak terdapat elektron bebas. Sedangkan F hanya membutuhkan 1 elektron dari Si sehingga dibutuhkan 4 unsur F agar terbentuk senyawa SiF4.
- atom pusat : Si
- PEI : 4
- PEB : ½(4 − 4) = 0
- tipe molekul : AX4
- bentuk molekul : tetrahedral
Jadi, bentuk molekul yang terjadi dari senyawa yang dibentuk oleh Si dan F sesuai kaidah oktet adalah tetrahedral (C).
Soal tentang Bentuk Molekul UN 2013
Bentuk molekul yang terjadi bila kedua unsur tersebut berikatan menurut aturan oktet adalah ….
A. linear
B. bentuk V
C. segi empat datar
D. segitiga piramida
E. segitiga bipiramida
Pembahasan
Elektron valensi unsur X dan Y adalah
X : 1s2 2s2 2p63s23p4 (ada 6 elektron valensi)
Y : 1s22s22p2 (ada 4 elektron valensi)
Unsur Y mempunyai 4 elektron valensi sehingga keempatnya harus berikatan agar terpenuhi kaidah oktet. Sedangkan atom X hanya membutuhkan 2 elektron untuk memenuhi aturan oktet. Berarti harus ada 2 unsur X agar bisa berikatan dengan Y membentuk YX2.
- atom pusat : Y
- PEI : 2 (rangkap = 4)
- PEB : ½(4 − 4) = 0
- tipe molekul : AX2
- bentuk molekul : linear
Jadi, bentuk molekul yang terjadi bila unsur X dan Y berikatan adalah linear (A).
Soal tentang Bentuk Molekul UN 2012
A. tetrahedral dan polar
B. tetrahedral dan nonpolar
C. bentuk V dan polar
D. bentuk V dan nonpolar
E. oktahedral dan nonpolar
Pembahasan
Elektron valensi unsur A dan B adalah
1A : 1s1 (1 elektron terluar)
8B : 1s2 2s2 2p4 (6 elektron terluar)
Unsur A hanya membutuhkan 1 elektron dari B agar terpenuhi kaidah duplet (kaidah 2). Sedangkan unsur B membutuhkan 2 elektron dari A agar terpenuhi kaidah oktet, berarti harus ada 2 unsur A agar dapat berikatan membentuk BA2.
- atom pusat : B
- PEI : 2
- PEB : ½(6 − 2) = 2
- tipe molekul : AX2E2
- bentuk molekul : bentuk V
Adanya elektron bebas menyebabkan bentuk molekulnya tidak simetris. Bentuk molekul yang tidak simetris ini merupakan ciri dari senyawa kovalen polar.
Jadi, senyawa yang terjadi dari ikatan antara unsur A dan B mempunyai bentuk molekul berbentuk huruf V dan bersifat polar (C).
Soal tentang Bentuk Molekul UN 2015
A. segi empat planar dan polar
B. linear dan polar
C. tetrahedral dan nonpolar
D. oktahedral dan nonpolar
E. linear dan nonpolar
Pembahasan
Elektron valensi dari unsur X dan Y adalah
4X : 1s2 2s2 (2 elektron valensi)
17Y : 1s2 2s2 2p6 3s2 3p5 (7 elektron valensi)
Unsur X menggunakan kedua elektronnya untuk berikatan dengan Y. Sementara itu, 1 unsur Y hanya mampu berikatan dengan 1 elektron unsur X. Berarti dibutuhkan 2 unsur Y agar dapat berikatan membentuk XY2.
- atom pusat : X
- PEI : 2
- PEB : ½(2 − 2) = 0
- tipe molekul : AX2
- bentuk molekul : linear
Tidak terdapatnya elektron bebas menyebabkan bentuk molekulnya simetris. Bentuk molekul yang simetris ini merupakan ciri dari senyawa kovalen nonpolar.
Jadi, bentuk molekul dan sifat kepolaran yang terjadi antara unsur X dan Y adalah linear dan bersifat nonpolar (E).
Pembahasan soal Bentuk Molekul yang lain bisa disimak di:
Pembahasan Kimia UN 2016 No. 6
Pembahasan Kimia UN 2017 No. 8
Pembahasan Kimia UN 2018 No. 3
Pembahasan Kimia UN 2019 No. 13
Simak juga, Pembahasan Soal UN: Tata Nama Senyawa Organik dan Anorganik.
Dapatkan pembahasan soal dalam file pdf di sini.
Terimakasih
Semoga Bermanfaat