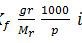pembahasan selanjutnya adalah
- sifat koligatif larutan,
- larutan penyangga,
- titrasi asam basa,
- senyawa karbon, dan
- makromolekul.
Soal No. 41 tentang Sifat Koligatif Larutan
A. 3/1
B. 2/1
C. 3/2
D. 4/3
E. 2/3
Pembahasan
Penurunan titik beku dirumuskan sebagai:

Karena disebutkan bahwa kedua senyawa terdisosiasi sempurna dalam air, maka harga i merupakan banyaknya partikel senyawa tersebut dalam air.
Ba(NO3)2 → Ba2+ + 2NO3−
(ada 3 partikel: 1 ion Ba2+ dan 2 ion NO3−, i = 3)
MgSO4 → Mg2+ + SO42−
(ada 2 partikel: 1 ion Mg2+ dan 1 ion SO42−, i = 2)
Kedua senyawa terlarut dalam air sehingga harga tetapan titik beku molal air (Kf) tidak berpengaruh. Diperoleh:

Jadi, perbandingan penurunan titik beku larutan A terhadap larutan B adalah 3/1 (A).
Soal No. 42 tentang Larutan Penyangga
A. 2
B. 4
C. 10 − log 5
D. 10
E. 12

Pembahasan
Nilai mol untuk masing-masing pereaksi adalah:
mol HCN = 200 mL × 0,3 M
= 60 mmol
mol KOH = 100 mL × 0,3 M
= 30 mmol
Persamaan reaksi untuk campuran tersebut adalah:
| HCN | + | KOH | → | KCN | + | H2O | ||
| awal | : | 60 | 30 | – | – | |||
| reaksi | : | 30 | 30 | 30 | 30 | |||
| sisa | : | 30 | – | 30 | 30 |
Jika persoalan berhenti sampai di sini maka sisa asam lemah HCN dan hasil reaksi garam KCN akan membentuk larutan penyangga. Tetapi karena ke dalam campuran masih ditambahkan NaOH maka sisa asam lemah tersebut akan bereaksi dengan NaOH.
mol NaOH = (0,8 g)/40
= 0,02 mol
= 20 mmol
Pada reaksi yang kedua ini, keadaan awal sudah terdapat ion CN− sebanyak 30 mmol sehingga persamaan reaksi antara HCN dan NaOH adalah:
| HCN | + | NaOH | → | NaCN | + | H2O | ||
| awal | : | 30 | 20 | 30 | 30 | |||
| reaksi | : | 20 | 20 | 20 | 20 | |||
| sisa | : | 10 | – | 50 | 50 |
Sisa HCN pada reaksi yang kedua ini akan membentuk larutan penyangga dengan garam NaCN yang terbentuk. pH yang terbentuk adalah:

pH = −log [H+]
= −log 10−10
= 10
Jadi, pH larutan yang terbentuk adalah 10 (D).
Soal No. 43 tentang Titrasi Asam Basa
A. 0,08 M
B. 0,40 M
C. 0,80 M
D. 1,60 M
E. 3,20 M
Pembahasan
Pertama, asam oksalat diencerkan.
M1 × V1 = M2 × V2
Indeks (1) adalah asam oksalat sebelum diencerkan sedangkan indeks (2) adalah asam oksalat sebelum diencerkan. Diperoleh:
M1 × 10 = M2 × 100
M2 = 0,1 M1
Kemudian asam oksalat yang telah diencerkan ini dititrasi dengan larutan basa NaOH.
M2 × V2 × na = Mb × Vb × nb
na dan nb masing-masing adalah jumlah ion H+ pada asam oksalat dan ion OH− pada basa NaOH. Karena disebutkan bahwa asam oksalat berbasa dua maka na = 2, sedangkan ion OH− pada basa NaOH sudah jelas satu, nb = 1. Diperoleh:
0,1 M1 × 25 × 2 = 0,2 × 20 × 1
M1 = 0,8
Jadi, konsentrasi awal larutan asam oksalat adalah 0,80 M (C).
Soal No. 44 tentang Senyawa Karbon
A. n-heksana
B. etanol
C. propanon
D. benzaldehida
E. etil etanoat
Pembahasan
Senyawa yang direduksi menghasilkan alkohol sekunder adalah senyawa dari golongan keton atau alkanon. Dari lima opsi yang termasuk golongan alkanon hanya propanon.
Sedangkan pereaksi Tollens digunakan untuk menguji adanya gugus aldehid. Reaksi positif ditunjukkan dengan dihasilkannya endapan cermin perak.
Jadi, senyawa organik tersebut adalah propanon (C).
Soal No. 45 tentang Makromolekul
A. amilase
B. amilosa
C. amilopektin\
D. amil alkohol
E. glikogen
Pembahasan
Amilase adalah makromolekul yang mempunyai gugus amino dan karboksilat sehingga jika dihidrolisis akan menghasilkan senyawa yang mempunyai gugus amino dan karboksilat.
Amilase berfungsi sebagai pemecah amilum sehingga dapat mempercepat hidrolisis amilum (bertindak sebagai biokatalis pencernaan).
Jadi, makromolekul tersebut adalah amilase (A).
Simak Pembahasan Soal TKD Saintek SBMPTN 2015 selengkapnya.
Simak juga:
Pembahasan Kimia SBMPTN 2014
Pembahasan Kimia SBMPTN 2016
Pembahasan Kimia SBMPTN 2017
Pembahasan Kimia UTBK SBMPTN 2019
Dapatkan pembahasan soal dalam file pdf di sini.
Terimakasih
Semoga Bermanfaat