pembahasan selanjutnya adalah
- energetika,
- sifat koligatif larutan,
- reaksi reduksi dan oksidasi,
- pergeseran kesetimbangan, serta
- konstanta kesetimbangan.
Soal No. 36 tentang Energetika
| Senyawa | NO (g) | O2 (g) | NO2 (g) |
| ∆Hfo (kJ/mol) | 90 | 0,00 | 34 |
Perubahan entalpi pembakaran 45 g gas NO (Mr = 30) sesuai reaksi:
2NO (g) + O2 (g) → 2NO2 (g)
adalah ….
A. −56 kJ
B. −84 kJ
C. −112 kJ
D. +56 kJ
E. +112 kJ
Pembahasan
Kita tentukan dulu perubahan entalpi standar pembakaran NO, yaitu perubahan entalpi saat koefisien NO sama dengan 1. Persamaan reaksi standarnya menjadi:
NO + ½O2 → NO2
Selanjutnya, kita tentukan perubahan entalpi reaksinya.
ΔHreaksi = ΔHhasil − ΔHpereaksi
= 34 − 90
= −56
Harga ΔH ini merupakan perubahan entalpi pembakaran 1 mol NO, yang disebut juga ΔHc.
ΔHc = −56 kJ/mol
Sedangkan perubahan entalpi pembakaran 45 g NO (Mr = 30) adalah:
ΔH = mol NO × ΔHc

= −84 kJ
Jadi, perubahan entalpi pembakaran gas 45 g gas NO adalah −84 kJ (B).
Soal No. 37 tentang Sifat Koligatif Larutan
A. 1,5t °C
B. 2t °C
C. 2,5t °C
D. 3t °C
E. 3,5t °C

Pembahasan
Garam LX2 adalah senyawa elektrolit dengan derajat ionisasi α = 0,5 yang mempunyai 1 kation L2+ dan 2 anion X− (n = 3). Faktor Van’t Hoff (i) untuk garam tersebut adalah:
i = {1 + (n − 1)α}
= {1 + (3 − 1)×0,5}
= 1 + 2 × 0,5
= 1 + 1
= 2
Sedangkan gula merupakan senyawa nonelektrolit sehingga nilai i = 1.
Sekarang kita perhatikan rumus penurunan titik beku.

Pada soal disebutkan bahwa gula 0,1 mol dan garam 0,1 mol, berarti nilai mol (gr/Mr) sama. Disebutkan pula bahwa kedua senyawa dilarutkan dalam air sehingga nilai Kf dan p untuk gula dan garam juga sama. Dengan demikian, yang memengaruhi penurunan titik beku hanya faktor Van’t Hoff.
Δtf ~ i

Δtf LX2 = 2t
Jadi, penurunan titik beku larutan garam LX2 adalah 2t °C (B).
Soal No. 38 tentang Reaksi Reduksi dan Oksidasi
IO3− (aq) + I− (aq) + H+ (aq) → I2 (aq) + H2O (l)
Perbandingan mol I− terhadap I2 pada reaksi setara adalah ….
A. 2 : 1
B. 1 : 5
C. 6 : 5
D. 3 : 3
E. 5 : 3
Pembahasan
Jumlah mol sebanding dengan koefisien. Sehingga untuk menentukan perbandingan mol cukup dengan menyetarakan reaksi tersebut kemudian kita bandingkan koefisiennya.
Karena yang ditanyakan perbandingan mol I− terhadap I2, kita hanya konsentrasi pada spesi yang mengandung I (unsur H dan O tidak mengalami perubahan biloks).
IO3− + I− → I2
Pada persamaan reaksi di atas, jumlah I ruas kiri sama dengan ruas kanan sehingga sudah setara atom. Kita tinggal menentukan perubahan bilangan oksidasi dari I.

Selanjutnya kita kalikan silang, perubahan biloks IO3− (5) kita kalikan pada I−. Demikian juga sebaliknya. Akibatnya, jumlah I ruas kiri menjadi 6. Kita tinggal menyetarakan atom I ruas kanan dengan mengalikan 3.
1IO3− + 5I− → 3I2
Jadi, perbandingan mol I− dan I2 adalah 5 : 3 (E).
Soal No. 39 tentang Pergeseran Kesetimbangan
3H2 (g) + N2 (g) ⇌ 2NH3 (g)
Data Kp dan Kc dari reaksi kesetimbangan tersebut pada berbagai temperatur adalah ….
| t (°C) | Kp | Kc |
| 25 300 400 |
9,0 × 105 4,6 × 10−9 2,6 × 10−10 |
5,4 × 108 1,0 × 10−5 8,0 × 10−7 |
Dari data tetapan kesetimbangan proses Haber-Bosch tersebut di atas, pernyataan yang benar adalah ….
A. untuk meningkatkan hasil reaksi (NH3) maka dapat dilakukan dengan cara menaikkan suhu
B. reaksi pembentukan amonia adalah reaksi eksoterm
C. perubahan entalpi reaksi peruraian amonia berharga negatif
D. produk peruraian amonia terjadi lebih besar pada suhu rendah
E. penambahan katalis akan menaikkan harga tetapan kesetimbangan
Pembahasan
Perhatikan rumus konstanta kesetimbangan konsentrasi (Kc) untuk reaksi tersebut.
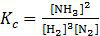
Berdasarkan rumus di atas, harga Kc sebanding dengan [NH3]2, artinya jika tetapan kesetimbangan meningkat maka produksi amonia juga meningkat.
Sedangkan menurut tabel, ketika suhu ditingkatkan maka harga Kc menurun, berarti produksi amonia juga menurun. [opsi A salah]
Saat suhu dinaikkan, produksi amonia menurun, berarti reaksi bergeser ke kiri. Menurut hukum pergeseran kesetimbangan, jika suhu dinaikkan maka reaksi akan bergeser ke endoterm. Dengan demikian:
- Reaksi ke kiri (peruraian amonia) adalah reaksi endoterm (ΔH berharga positif). [opsi C salah]
- Reaksi ke kanan (pembentukan amonia) adalah reaksi eksoterm. [opsi B benar]
Sedangkan katalis hanya berfungsi mempercepat reaksi, tidak memengaruhi pergeseran maupun tetapan kesetimbangan. [opsi E salah]
Jadi, pernyataan yang benar adalah opsi (B).
Soal No. 40 tentang Konstanta Kesetimbangan
A. 3000 atm
B. 3100 atm
C. 3011 atm
D. 3101 atm
E. 3111 atm
Pembahasan
Soal nomor 40 ini berhubungan dengan soal nomor 39. Data-data yang kita perlukan:
Kp = 9,0 × 105
PH2 = 1 atm
PN2 = 10 atm
Konstanta kesetimbangan tekanan parsial untuk reaksi tersebut dirumuskan sebagai:
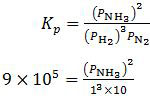
(PNH3)2 = 9,0 × 106 [dikalikan silang]
PNH3 = 3,0 × 103 [kedua ruas ditarik akar]
= 3000
Dengan demikian, tekanan total sistem tersebut adalah:
Pt = PH2 + PN2 + PNH3
= 1 + 10 + 3000
= 3011
Jadi, tekanan total sistem pada kesetimbangan tersebut adalah 3011 atm (C).
Simak Pembahasan Soal TKD Saintek SBMPTN 2014 selengkapnya.
Dapatkan pembahasan soal dalam file pdf di sini.
Terimakasih
Semoga Bermanfaat