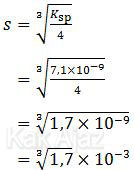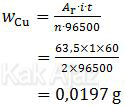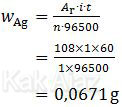pembahasan selanjutnya adalah
 |
| Elektrolisis Vakum |
Pembahasan soal Kimia Tes Kemampuan Dasar Sains dan Teknologi (TKD Saintek) Seleksi Bersama Masuk Perguruan Tinggi Negeri (SBMPTN) tahun 2017 Kode Naskah 157 nomor 41 sampai dengan nomor 45 tentang:
- kelarutan dan hasil kali kelarutan,
- senyawa karbon,
- reaksi reduksi dan oksidasi,
- sel elektrolisis, serta
- isomer senyawa karbon.
Soal No. 41 tentang Kelarutan dan Hasil Kali Kelarutan
A. PbSO4 mudah larut dibandingkan PbI2
B. diperlukan lebih banyak SO42− daripada I− untuk mendapatkan Pb2+ dari dalam larutan
C. kelarutan PbSO4 sama dengan kelarutan PbI2
D. kelarutan PbSO4 lebih besar daripada kelarutan PbI2
E. kelarutan PbI2 lebih besar daripada kelarutan PbSO4
Pembahasan
PbSO4 terionisasi menjadi 1Pb2+ + 1SO42− sedangkan PbI2 terionisasi menjadi 1Pb2+ + 2I− sehingga dibutuhkan lebih banyak I− untuk mendapatkan Pb2+[opsi B salah]
Hubungan antara kelarutan (s) dan hasil kali kelarutan (Ksp) memenuhi rumus berikut:
Untuk senyawa XmYn berlaku
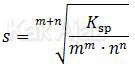
Berpedoman pada rumus di atas, diperoleh:
Berdasarkan penghitungan harga kelarutan kedua senyawa tersebut dapat disimpulkan:
- Kelarutan PbI2 lebih besar daripada kelarutan PbSO4[opsi C dan D salah, opsi E benar]
- Karena kelarutan PbI2 lebih besar maka PbI2 lebih mudah larut daripada PbSO4[opsi A salah]
Jadi, pernyataan yang benar adalah opsi (E).
Soal No. 42 tentang Senyawa Karbon
A. butanadiol
B. butanon
C. 2-metilpropanon
D. asam 2-metilpropanoat
E. metilpropanoat

Pembahasan
2-metil-1-propanol adalah golongan alkohol primer. Hal diketahui dari namanya, 1-propanol, yang berarti gugus −OH terikat pada atom C yang paling ujung.
Berikut ini oksidasi yang terjadi pada golongan alkohol.

Berdasarkan bagan di atas, 2-metil-1-propanol yang merupakan alkohol primer ketika dioksidasi akan menghasilkan aldehid/alkanal. Mari kita periksa setiap opsi jawaban yang tersedia!
butanadiol : alkohol bivalen
butanon : keton/alkanon
2-metilpropanon : keton/alkanon
asam 2-metilpropanoat : asam karboksilat
metilpropanoat : alkil alkanoat/ester
Ternyata dari semua opsi jawaban tidak ada yang berasal dari golongan aldehid. Berarti yang dimaksud adalah oksidasi dua kali yang akan menghasilkan asam karboksilat.
Hal ini karena oksidasi tersebut menggunakan katalis asam bikromat (H2Cr2O7) yang notabene merupakan oksidator kuat.
Jadi, oksidasi 2-metil-1-propanol menghasilkan asam 2-metilpropanoat (D).
Soal No. 43 tentang Reaksi Reduksi dan Oksidasi
- Ca(OH)2(aq) + H2SO4(aq) → CaSO4(s) + H2O(l)
- Pb(s) + H2SO4(aq) + PbO2(s) → PbSO4(s) + H2O(l)
- H2S(aq) + CdCl2(s) → HCl(aq) + CdS(s)
- NaCl(aq) + F2(g) → NaF(aq) + Cl2(g)
Pembahasan
Reaksi reduksi-oksidasi adalah reaksi di mana terdapat unsur-unsur yang mengalami perubahan bilangan oksidasi.
Suatu reaksi termasuk redoks atau bukan, dapat ditentukan dengan mudah bila persamaan reaksinya berbentuk senyawa (bukan ion) sebagaimana tersaji dalam opsi jawaban di atas.
Caranya, carilah unsur tunggal (misal Na) atau molekul unsur (contoh Cl2) dalam reaksi tersebut. Jika ketemu maka itulah reaksi redoks.
Kok bisa? Perhatikan reaksi nomor 2. Di ruas kiri terdapat unsur Pb dan di ruas kanan terdapat senyawa PbO2.
Biloks Pb di ruas kiri pasti nol (karena unsur) sedangkan biloks Pb dalam senyawa PbO2 pasti tidak nol. Artinya, Pb pasti mengalami perubahan biloks. Sehingga reaksi nomor 2 pasti reaksi redoks.
Demikian juga dengan reaksi nomor 4. Dalam reaksi tersebut terdapat F2 dan Cl2 yang biloks pasti nol. Sedangkan biloks senyawanya (NaF dan NaCl) pasti tidak nol.
Jadi, yang merupakan reaksi reduksi-oksidasi adalah reaksi nomor 2 dan 4 sehingga jawabannya adalah opsi (C).
Soal No. 44 tentang Sel Elektrolisis
- massa Cu yang mengendap lebih besar daripada massa Ag
- jumlah atom Cu yang mengendap sama dengan jumlah atom Ag.
- Volume gas O2 yang dihasilkan pada bejana A lebih besar daripada volume gas O2 yang dihasilkan pada bejana B
- pH larutan dalam bejana A sama dengan pH larutan dalam bejana B
Pembahasan
Reaksi yang terjadi pada katoda dan anoda adalah sebagai berikut:
Bejana A
katoda : Cu2+ + 2e → Cu
anoda : 2H2O → 4H+ + O2 + 4e
Bejana B
katoda : Ag+ + e → Ag
anoda : 2H2O → 4H+ + O2 + 4e
Mari kita ulas satu per satu pernyataan-pernyataan di atas!
- Massa Cu dan Ag yang mengendap pada katoda dapat ditentukan dengan hukum I Faraday.
Massa Cu (Ar = 63,5; n = 2)
Massa Ag (Ar = 108; n = 1)
∴ Massa Ag yang mengendap lebih besar daripada massa Cu. [pernyataan 1 salah]
- Jumlah atom Cu dan Ag dapat ditentukan dengan mengalikan jumlah mol atom tersebut dengan bilangan Avogadro (6,02∙〖10〗^23 ).
∴ Jumlah atom Ag yang mengendap lebih banyak daripada jumlah atom Cu. [pernyataan 2 salah]
A. 1, 2, 3
B. 1, 3
C. 2, 4
D. 4
E. 1, 2, 3, 4
Jika pernyataan 1 salah, otomatis opsi A, B, dan E pasti salah. Kita tinggal menentukan kebenaran pernyataan 2 saja. Ternyata pernyataan 2 salah. Sehingga jawabannya sudah pasti opsi D.
Baiklah, agar pembahasan lebih panjang, kita cari juga kebenaran pernyataan 3 dan 4.
- Gas O2 terbentuk di anoda. Sedangkan reaksi di anoda, baik pada bejana A maupun B, adalah sama. Sehingga jumlah O2 yang dihasilkan pada bejana A dan B juga sama.
Karena volume setara dengan jumlah mol maka volume gas O2 yang dihasilkan pada bejana A sama dengan volume gas O2 yang dihasilkan pada bejana B. [pernyataan 3 salah]
- Nilai pH bergantung pada konsentrasi [H+]. Sedangkan ion H+ dihasilkan di anoda. Karena ion H+ yang dihasilkan pada bejana A sama dengan bejana B maka pH larutan dalam bejana A sama dengan pH larutan dalam bejana B. [pernyataan 4 benar]
Jadi, pernyataan yang benar adalah pernyataan 4 saja sehingga jawabannya adalah opsi (D).
Soal No. 45 tentang Isomer Senyawa Karbon

Pembahasan
Isomer suatu senyawa adalah senyawa lain yang mempunyai rumus molekul sama tetapi rumus struktur berbeda.
Asam siklopentilmetanoat adalah sikloalkana yang bertindak sebagai alkil pada asam metanoat. Berikut ini rumus struktur dan rumus molekul dari asam siklopentilmetanoat.

Nah, sekarang kita cari rumus struktur pada soal yang mempunyai rumus molekul C6H10O2.
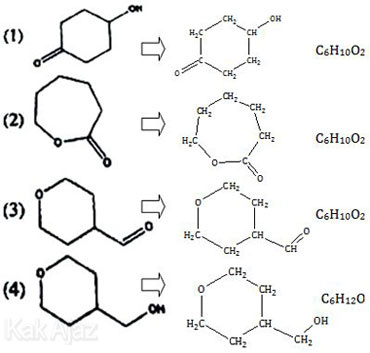
Jadi, isomer asam siklopentilmetanoat adalah nomor 1, 2, dan 3 sehingga jawabannya adalah opsi (A).
Simak Pembahasan Soal TKD Saintek SBMPTN 2017 selengkapnya.
Simak juga:
Pembahasan Kimia SBMPTN 2014
Pembahasan Kimia SBMPTN 2015
Pembahasan Kimia SBMPTN 2016
Pembahasan Kimia UTBK SBMPTN 2019
Dapatkan pembahasan soal dalam file pdf di sini.
Terimakasih
Semoga Bermanfaat