pembahasan selanjutnya adalah

Pembahasan soal Kimia Ujian Nasional (UN) tahun 2017 nomor 11 sampai dengan nomor 15 tentang:
- tata nama senyawa organik dan anorganik,
- hukum dasar kimia [hukum Dalton],
- hukum dasar kimia [hukum Proust],
- hukum dasar kimia [hukum Gay-Lussac], serta
- senyawa hidrokarbon.
Soal No. 11 tentang Tata Nama Senyawa Organik dan Anorganik
| No. | Rumus Senyawa | Nama Senyawa |
| (1) | Al(OH)3 | Aluminium(III) hidroksida |
| (2) | Cr(OH)3 | Krom(III) hidroksida |
| (3) | Hg2Cl2 | Raksa(II) klorida |
| (4) | PbSO4 | Timbal(II) sulfat |
| (5) | ZnO | Seng(II) oksida |
Pasangan yang tepat antara rumus dan nama senyawanya adalah ….
A. (1) dan (3)
B. (1) dan (4)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (5)
Pembahasan
Semua senyawa di atas tersusun dari unsur logam dan nonlogam. Logam yang hanya mempunyai satu bilangan oksidasi (semua logam golongan utama + Zn), penamaannya cukup dengan menyebut nama logam diikuti nama nonlogam dengan akhiran -ida.
| Al(OH)3 | : | aluminium hidroksida |
| ZnO | : | seng oksida |
Akan tetapi jika unsur logam mempunyai lebih dari bilangan oksidasi, maka nama senyawa diberikan dengan menyebut nama logam + (huruf romawi biloks logam) + nama nonlogam dengan akhiran -ida.
| Cr(OH)3 | : | krom(III) klorida |
| Hg2Cl2 | : | raksa(1) klorida |
| PbSO4 | : | timbal(II) sulfat |
Jadi, pasangan yang tepat antara rumus dan nama senyawanya adalah 2 dan 4 (D).
Perdalam materi ini di Pembahasan Kimia UN: Tata Nama Senyawa Organik dan Anorganik.
Soal No. 12 tentang Hukum Dasar Kimia [Hukum Dalton]
| Senyawa | Persentase | |
| S | O | |
| I | 50 | |
| II | 40 | 60 |
Perbandingan massa unsur oksigen dalam dua senyawa tersebut sesuai Hukum Dalton adalah ….
A. 1 : 1
B. 1 : 2
C. 2 : 1
D. 2 : 3
E. 3 : 2

Pembahasan
John Dalton (1766 – 1844) merumuskan Hukum Kelipatan Perbandingan (Hukum Dalton) sebagai berikut:
Jika dua jenis unsur bergabung membentuk lebih dari satu macam senyawa maka perbandingan massa unsur dalam senyawa-senyawa tersebut merupakan bilangan bulat sederhana.
Perhatikan perbandingan persentase unsur S dan O pada senyawa I dan II berikut:
Senyawa I = 50 : 50 = 1 : 1 [dibagi 50]
Senyawa II = 40 : 60 = 1 : 3/2 [dibagi 40]
Sehingga perbandingan massa unsur O dalam senyawa I dan II adalah:
1 : 3/2 = 2 : 3 [masing-masing dikalikan 2]
Jadi, perbandingan massa unsur oksigen dalam dua senyawa tersebut sesuai Hukum Dalton adalah 2 : 3 (D).
Perdalam materi ini di Pembahasan Kimia UN: Hukum Dasar Kimia.
Soal No. 13 tentang Hukum Dasar Kimia [Hukum Proust]
| No. | Massa (gram) | ||
| Pb | S | PbS | |
| 1. | 10 | 1,6 | 11,6 |
| 2. | 15 | 15 | 17,4 |
| 3. | 30 | 4,8 | 34,8 |
Jika massa Pb yang digunakan sebanyak 25 g, massa S yang diperlukan sebanyak ….
A. 1 gram
B. 2 gram
C. 4 gram
D. 5 gram
E. 6 gram
Pembahasan
Tahun 1799 Joseph Proust merumuskan Hukum Perbandingan Tetap (Hukum Proust) yang berbunyi:
Perbandingan massa unsur-unsur dalam suatu senyawa adalah tetap.
Berdasarkan hukum tersebut, mari kita cari pada tabel, reaksi mana penjumlah massa Pb dan S yang hasilnya sama dengan massa PbS. Ya, reaksi nomor 1 dan 3. Kita ambil saja reaksi nomor 1.
| Pb | : | S | : | PbS | |
| 10 | : | 1,6 | : | 11,6 | |
| 100 | : | 16 | : | 116 | [kali 10] |
| 25 | : | 4 | : | 29 | [bagi 4] |
Jadi, jika massa Pb yang digunakan sebanyak 25 gram, massa S yang diperlukan sebanyak 4 gram (C).
Perdalam materi ini di Pembahasan Kimia UN: Hukum Dasar Kimia.
Soal No. 14 tentang Hukum Dasar Kimia [Hukum Gay-Lussac]
C3H8(g) + 5O2(g) → 3CO2(g) + 4H2O(l)
C4H8(g) + 6O2(g) → 4CO2(g) + 4H2O(l)
Volume gas CO2 setelah pembakaran adalah 68 L. Volume gas propana dan butena dalam campuran berturut-turut adalah ….
A. 8 L dan 12 L
B. 10 L dan 10 L
C. 12 L dan 8 L
D. 14 L dan 6 L
E. 16 L dan 4 L
Pembahasan
Pada tahun 1808 Joseph Louis Gay-Lussac (1778 –1850) mengemukakan Hukum Perbandingan Volume (Hukum Gay-Lussac) yang berbunyi:
Pada suhu dan tekanan yang sama, perbandingan volume gas-gas yang bereaksi dan volume gas-gas hasil reaksi merupakan bilangan bulat sederhana.
Perbandingan volume tersebut setara dengan perbandingan koefisien masing-masing zat.
Volume 20 L merupakan volume campuran gas propana dan butena. Misal volume gas propana adalah x maka volume butena adalah 20 − x.
| C3H8(g) | + | 5O2(g) | → | 3CO2(g) | + | 4H2O(l) |
| x | 5x | 3x | 4x |
| C4H8(g) | + | 6O2(g) | → | 4CO2(g) | + | 4H2O(l) |
| 20 − x | 6(20 − x) | 4(20 − x) | 4(20 − x) |
Diketahui bahwa volume gas CO2 setelah pembakaran adalah 68 L. Artinya, volume gas CO2 hasil pembakaran propana dijumlah dengan volume gas CO2 hasil pembakaran butena sama dengan 68 L.
3x + 4(20 − x) = 68
3x + 80 − 4x = 68
80 − 68 = 4x − 3x
x = 12
Dengan demikian,
Volume C3H8 = x
= 12
Volume C4H8 = 20 − x
= 20 − 12
= 8
Jadi, volume gas propana dan butena dalam campuran berturut-turut adalah 8 12 L dan 12 8 L (A C).
Perdalam materi ini di Pembahasan Kimia UN: Hukum Dasar Kimia.
Soal No. 15 tentang Senyawa Hidrokarbon

Berdasarkan grafik dapat diprediksi senyawa P, Q, dan R tersebut berturut-turut adalah ….
| P | Q | R | |
| A | n-pentana | 2-metilbutana | 2,2-dimetilpropana |
| B | n-pentana | 2,2-dimetilpropana | 2-metilbutana |
| C | 2-metilbutana | 2,2-dimetilpropana | n-pentana |
| D | 2,2-dimetilpropana | n-pentana | 2-metilbutana |
| E | 2,2-dimetilpropana | 2-metilbutana | n-pentana |
Pembahasan
Senyawa C5H12 adalah pentana dan isomernya, termasuk dalam golongan alkana. Alkana rantai lurus mempunyai titik didih lebih tinggi dibanding alkana rantai bercabang. Semakin banyak cabang, titik didih makin rendah.
Mari kita perhatikan rumus struktur ketiga senyawa tersebut!
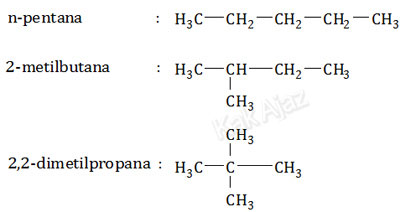
Berdasarkan rumus struktur di atas dapat disimpulkan bahwa:
- Senyawa P adalah 2,2-dimetilpropana karena cabangnya paling banyak sehingga titik didihnya paling rendah.
- Senyawa Q adalah 2-metilbutana karena cabangnya lebih sedikit sehingga titik didihnya lebih tinggi.
- Senyawa R adalah n-pentana karena rantainya lurus tak bercabang sehingga titik didihnya paling tinggi.
Jadi, senyawa P, Q, dan R yang tepat adalah opsi (E).
Simak Pembahasan Soal Kimia UN 2017 selengkapnya.
Dapatkan pembahasan soal dalam file pdf di sini.
Terimakasih
Semoga Bermanfaat
