pembahasan selanjutnya adalah

Pembahasan soal Kimia Ujian Nasional (UN) tahun 2019 nomor 11 sampai dengan nomor 15 tentang:
- kegunaan senyawa kimia,
- jenis ikatan kimia,
- bentuk molekul,
- sistem periodik unsur, dan
- termokimia [perubahan entalpi].
Soal No. 11 tentang Kegunaan Senyawa Kimia
- Digunakan untuk pengembang roti.
- Digunakan untuk bahan baku pupuk.
- Digunakan untuk pengawet kayu.
- Digunakan sebagai bahan baku pembuatan TNT.
- Dipakai untuk pengempal daging.
Kegunaan senyawa asam nitrat yang tepat terdapat pada pasangan nomor ….
A. (1) dan (2)
B. (1) dan (4)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (5)
Pembahasan
Beberapa kegunaan asam nitrat (HNO3) antara lain:
- menuakan usia kayu (memunculkan alur serat kayu)
- bahan pembuatan pupuk amonium nitrat [pernyataan 2]
- bahan baku TNT (peledak) [pernyataan 4]
- bahan baku pewarna
- bahan pembuatan pakaian dan karpet
- pembuatan peralatan listrik, sol sepatu, matras, lem, dan lain-lain
Sementara itu,
- pengembang roti fungsi dari soda kue (NaHCO3)
- pengawet kayu fungsi dari batu kapur (CaCO3)
- pengempal daging fungsi dari boraks (Na2B4O7)
Jadi, kegunaan senyawa asam nitrat yang tepat terdapat pada pasangan nomor 2 dan 4 (D).
Soal No. 12 tentang Jenis Ikatan Kimia

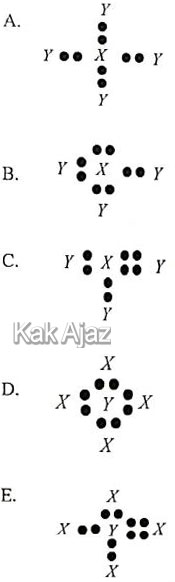
Bila unsur X dan Y berikatan, struktur Lewis molekul senyawa yang terbentuk adalah ….
Pembahasan
Konfigurasi elektron untuk atom X dan Y adalah:
6X : 2, 4 [kurang 4 agar tercapai oktet (8)]
1Y : 1 [kurang 1 agar tercapai duplet (2)]
Artinya, atom X membutuhkan 4 atom Y untuk berikatan sehingga terbentuk molekul XY4.
Struktur Lewis dari senyawa XY4 adalah:

Jadi, struktur Lewis molekul senyawa yang terbentuk adalah opsi (A).
Perdalam materi ini di Pembahasan Kimia UN: Jenis Ikatan Kimia.
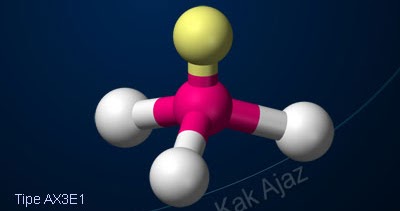
Soal No. 13 tentang Bentuk Molekul

Berdasarkan data, tipe, dan geometri molekul SF4 dan NF3 berturut-turut ditunjukkan oleh nomor ….
A. (2) dan (1)
B. (3) dan (2)
C. (3) dan (5)
D. (4) dan (1)
E. (5) dan (4)

Pembahasan
Konfigurasi elektron S dan F
16S = 2, 8, 6 (6 elektron terluar)
9F = 2, 7 (7 elektron terluar)
Untuk membentuk molekul SF4, 4 dari 6 elektron terluar S mengikat 4 unsur F. Sisa 2 elektron bertindak sebagai 1 pasang elektron bebas. Sehingga:
- pasangan elektron ikatan (PEI) = 4
- pasangan elektron bebas (PEB) = 1
- tipe molekul = AX4E
Pada tabel tidak ada tipe AX4E, tetapi ada AX4 dengan PEB = 1. [nomor 5]
Konfigurasi elektron N dan F
7N = 2, 5 (5 elektron terluar)
9F = 2, 7 (7 elektron terluar)
Untuk membentuk molekul NF3, 3 dari 5 elektron terluar N mengikat 3 unsur F. Sisa 2 elektron bertindak sebagai sepasang elektron bebas. Sehingga:
- pasangan elektron ikatan (PEI) = 3
- pasangan elektron bebas (PEB) = 1
- tipe molekul = AX3E
Pada tabel juga tidak ada tipe AX3E, tetapi ada AX3 dengan PEB = 1. [nomor 4]
Jadi, data, tipe, dan geometri molekul SF4 dan SF4 dan NF3 berturut-turut ditunjukkan oleh nomor 5 dan 4 (E).
Perdalam materi in di Pembahasan Kimia UN: Bentuk Molekul.
Soal No. 14 tentang Sistem Periodik Unsur
Grafik yang tepat untuk menggambarkan hubungan antara afinitas elektron dengan nomor atom keempat unsur tersebut adalah ….

Pembahasan
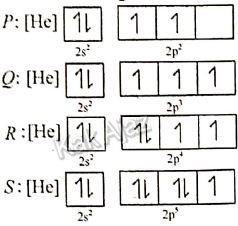
Jika diperhatikan konfigurasi keempat unsur tersebut maka dapat diperoleh data:
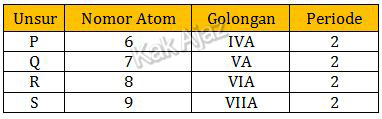
Artinya, keempat unsur tersebut terletak dalam satu periode, tepatnya periode 2.
Dalam satu periode dari kiri ke kanan, afinitas elektron cenderung meningkat, kecuali pada golongan IIA dan VA.

Dengan demikian, afinitas elektron untuk keempat unsur tersebut akan naik kecuali pada unsur Q.
Jadi, grafik yang menggambarkan hubungan antara afinitas elektron dengan nomor atom keempat unsur tersebut adalah opsi (C D).
Perdalam materi ini di Pembahasan Kimia UN: Sistem Periodik Unsur.
Soal No. 15 tentang Termokimia [perubahan entalpi]
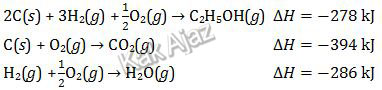
Besarnya perubahan entalpi pembakaran standar C2H5OH menurut reaksi:
C2H5OH(l) + 3O2(g) → 2CO2(g) + 3H2O(g)
adalah ….
A. −1368 kJ
B. −958 kJ
C. −402 kJ
D. +1368 kJ
E. +1922,20 kJ
Pembahasan
Tiga tahapan reaksi di atas kita sesuaikan koefisien dan letak ruasnya agar tercapai reaksi akhir.

Dengan demikian, perubahan entalpinya adalah:
x = −278 × (−1) + (−394) × 2 + (−286) × 3
= 278 − 788 − 858
= −1368
Jadi, besar perubahan entalpi pembakaran standar C2H5OH adalah −1368 kJ (A).
Perdalam materi ini di Pembahasan Kimia UN: Termokimia.
Simak Pembahasan Soal Kimia UN 2019 selengkapnya.
Dapatkan pembahasan soal dalam file pdf di sini.
Terimakasih
Semoga Bermanfaat